题目内容
1.A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中离子半径最小的,则它们的原子序数由小到大的顺序是( )| A. | E、C、D、B、A | B. | B、A、E、D、C | C. | E、B、A、D、C | D. | A、B、C、D、E |
分析 同周期元素从左到右,随着原子序数的递增,元素的金属性减弱,非金属性增强,原子半径在逐渐减小;A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A,则原子序数B<A;C、D最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,原子序数:C>D,则A、B、C、D的原子序数由小到大的顺序为:B<A<D<C,五种元素形成的简单离子中,E的离子半径最小,E应为金属,以此解答该题.
解答 解:A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,则A、B为金属元素,且碱性B>A,则原子序数B<A;C、D最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,原子序数:C>D;
由同周期元素从左到右,元素的金属性减弱,非金属性增强,则A、B、C、D的原子序数由小到大的顺序为:B<A<D<C,
五种元素形成的简单离子中,E的离子半径最小,则E应为金属,又E的离子半径最小,所以E的原子序数大于AB的原子序数,所以它们的原子序数由小到大的顺序是B、A、E、D、C,
故选B.
点评 本题考查位置、结构、性质的关系,题目难度不大,明确同周期元素性质的变化规律是解答本题的关键,试题侧重基础知识的考查,有利于培养学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.关于煤、石油、天然气等化石燃料的说法不正确的是( )
| A. | 石油分馏是物理变化,可得到汽油、煤油和柴油等产品 | |
| B. | 石油的催化重整和煤的干馏均可以得到芳香烃 | |
| C. | 石油裂解的目的主要是为了得到更多的汽油 | |
| D. | 煤、石油、天然气既是一次能源,又是不可再生能源 |
9.某有机化合物3.1g完全燃烧生成4.4g CO2和2.7gH2O,无其它物质生成.下列说法正确的是( )
| A. | 该化合物肯定含O元素 | B. | 该化合物属于烃 | ||
| C. | 该化合物的相对分子质量肯定为3l | D. | 该化合物的结构只有一种 |
6.现有反应 3Fe(s,粉末)+4H2O(g)$\stackrel{△}{?}$Fe3O4(s)+4H2(g),采取下列措施可以改变反应速率的是( )
| A. | 增加Fe粉的用量 | |
| B. | 充入Ar,保持容器内体积不变 | |
| C. | 保持容器体积不变,增加水蒸气输入量 | |
| D. | 充入Ar,保持容器内压强不变 |
13.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: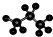 | |
| D. | 第三周期简单阴离子结构示意图均可表示为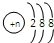 |
10.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-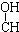 - -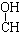 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-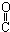 -CH2-CHO -CH2-CHO |
 ;
;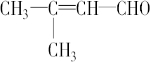 .
.