题目内容
3.下列关于元素的叙述正确的是( )| A. | 氟元素的非金属性最强,所以氢氟酸的酸性最强 | |
| B. | 元素的金属性越强,其最外层电子数就越少 | |
| C. | 在天然元素中,都含有同位素 | |
| D. | 某元素的原子及其阴离子的核外电子层数等于该元素所在的周期数 |
分析 A.氢化物酸性不能比较元素的非金属性强弱,氢氟酸属于弱酸;
B.金属性强弱与失去电子的难易有关,与最外层电子数无关;
C.有的元素没有同位素;
D.原子形成简单阴离子,电子层不变,电子层等于周期数.
解答 解:A.非金属性F>Cl,氢氟酸属于弱酸,HCl是强酸,氢化物酸性不能比较元素的非金属性强弱,故A错误;
B.金属性强弱与失去电子的难易有关,与最外层电子数无关,如Na最外层1个电子、Ca最外层2个电子,金属性Ca>Na,故B错误;
C.不是所有的元素都有同位素,有的元素没有同位素,如Na,故C错误;
D.某元素的原子的电子层等于周期数,原子形成简单阴离子,电子层不变,阴离子电子层等于周期数,故D正确;
故选D.
点评 本题考查结构性质位置关系,难度不大,旨在考查学生对基础知识的掌握,注意把握元素非金属性和金属性的判断.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
13.下列说法正确的是( )
| A. | 在NaHS溶液中滴入少量的CuCl2溶液产生黑色沉淀,HS-电离程度增大,反应后溶液pH减小 | |
| B. | 浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 | |
| C. | 在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
11.用石墨电极电解NaCl和CuSO4的混合溶液,开始时和一段时间后阴极析出的物质依次是( )
| A. | H2和Cl2 | B. | Cu和 O2 | C. | H2和Na | D. | Cu 和 H2 |
15.某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且原子序数依次增大,Y、Z处于相邻主族,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.则下列判断正确的是( )
| A. | Y、Z的氧化物都有两性 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | 原子半径:W>Y>Z>X | |
| D. | 最高价氧化物对应水化物的碱性:W<Y |
13.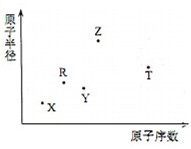 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点不一定是:Y>R | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |

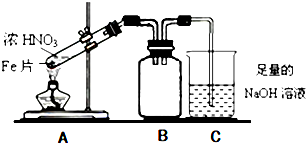
 的系统名称是3,4-二甲基-3-乙基己烷.
的系统名称是3,4-二甲基-3-乙基己烷. .
.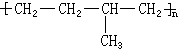 形成该高聚物的单体的结构简式分别为
形成该高聚物的单体的结构简式分别为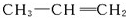 、
、 .
.