题目内容
1.为实现下列实验目的,所用试剂合理的是( )| 选项 | 实验目的 | 试剂 |
| A | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| B | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| C | 检验Fe3O4溶于盐酸后的金属阳离子 | NaOH溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴水、KI溶液反应生成碘,淀粉遇碘变蓝;
B.二者均与盐酸反应;
C.Fe3O4溶于盐酸后生成二价铁离子和三价铁离子;
D.饱和FeCl3溶液、NaOH溶液反应生成沉淀.
解答 解:A.溴水、KI溶液反应生成碘,淀粉遇碘变蓝,Br元素的化合价降低,则验证Br2的氧化性强于I2,故A正确;
B.二者均与盐酸反应,不能除杂,用NaOH溶液除去Fe2O3中的Al2O3,故B错误;
C.Fe3O4溶于盐酸后生成二价铁离子和三价铁离子,加入氢氧化钠只看到红褐色沉淀,无法确定二价铁离子,故C错误;
D.饱和FeCl3溶液、NaOH溶液反应生成沉淀,应饱和氯化铁水解制备胶体,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、氧化还原反应等,把握物离子检验、胶体制备等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
11.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、Al3+、Ba2+、SO42-、OH-,现取两份100mL该溶液进行如下实验:
(1)第一份加足量BaCl2溶液后,得干燥沉淀4.66g;
(2)第二份加NaOH溶液有沉淀产生,继续滴加至沉淀溶解,共消耗NaOH 0.04mol;
根据上述实验,以下推测正确的是( )
(1)第一份加足量BaCl2溶液后,得干燥沉淀4.66g;
(2)第二份加NaOH溶液有沉淀产生,继续滴加至沉淀溶解,共消耗NaOH 0.04mol;
根据上述实验,以下推测正确的是( )
| A. | C(SO42- )为0.02mol/L | B. | 100mL溶液中含有0.01mol Al3+ | ||
| C. | 溶液中一定存在Na+ | D. | 无法确定是否含有SO42- |
16.下列液体均处于25℃,有关叙述正确的是( )
| A. | 相同体积,PH值均为2的盐酸和醋酸分别与NaOH反应,消耗NaOH一样多 | |
| B. | pH=4的醋酸与PH=10的NaOH溶液等体积混合后,PH<7 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
6.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO${\;}_{4}^{2-}$ | B. | Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | ||
| C. | K+、Fe3+、NO${\;}_{3}^{-}$、SCN- | D. | Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{4}^{2-}$ |
10.下列说法错误的是( )
| A. | 使用分液漏斗、容量瓶前都应先检漏 | |
| B. | 用托盘天平可以称取25.12g NaCl固体 | |
| C. | 仰视量筒刻度线量取浓硫酸配成的稀硫酸浓度偏高 | |
| D. | 不用任何试剂可以鉴别开NaOH、MgSO4、Ba(NO3)2、Cu(NO3)2、KNO3 五种溶液 |
11.下列说法正确的是( )
| A. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 按系统命名法,化合物 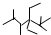 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
 .
.