题目内容
在密闭容器中有可逆反应:nA(g)+mB(g) pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
升温,c(B)/c(C)的比值变小
降温时体系内混合气体平均分子量变小
加入 B,A 的转化率减小
加入催化剂,气体总的物质的量不变
加压使容器体积减小,A 或 B 的浓度一定增大
⑥ 若 A 的反应速率为 v A ,则 B 的反应速率 v B =(n/m)v
A、①②④⑤ B、①②③⑤ C、①②③⑥ D、③④⑤⑥
| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
| A. | 生成白色沉淀及气泡 | B. | 仅生成白色沉淀 | ||
| C. | 仅有气泡产生 | D. | 无变化 |
(一)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ 。
(二)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视。某研究机构需得到C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但直接测定实验难进行,可通过下图中各组物质能量总和及相互间 转化中的能量变化计算得到:
转化中的能量变化计算得到:

①判断:ΔH________0(选填“>”、“<”或“=”)。
②ΔH=___________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生 成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)
成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)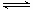 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的反应的热化学方程式: _ _ _。



 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )