题目内容
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水.下列说法正确的是( )
| A、混合气体一定没有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中一定有乙烯 |
考点:有关混合物反应的计算
专题:烃及其衍生物的燃烧规律
分析:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而烃类中碳原子数小于1的只有甲烷,判断混合气体中一定含有甲烷,再根据甲烷中含有4个氢原子,则另一种烃中一定含有4个H原子,然后根据平均分子式对各选项进行判断.
| 3.6g |
| 18g/mol |
解答:
解:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而烃类中碳原子数小于1的只有甲烷,判断混合气体中一定含有甲烷,根据甲烷中含有4个氢原子,则另一种烃中一定含有4个H原子,可能含有乙烯,一定不含乙烷,所以ABD错误,C正确,故选C.
| 3.6g |
| 18g/mol |
点评:本题考查了有机物分子式的确定、混合物计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
已知元素R和Q的价电子排布如下,不能形成 RQ2型化合物的是( )
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )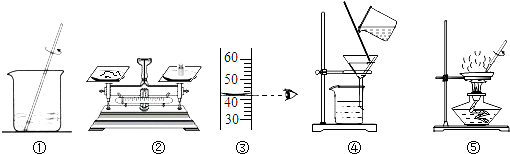

| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
请用所学有机化学知识判断下列表述,其中正确的是( )
| A、用大米酿造的酒在一定条件下密封保存,时间越长越香醇 |
| B、欲将蛋白质从溶液中析出而又不改变它的性质,可加CuSO4溶液 |
| C、乙烯使溴水褪色与苯使溴水褪色的原因相同 |
| D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应高温 |
 如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作: 硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略) 
 工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.
工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.