题目内容
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.(1)N位于周期表中第
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+的电子排布式为
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式
(6)Cu3N的晶胞结构如图,N3-的配位数为
考点:晶胞的计算,元素电离能、电负性的含义及应用,极性分子和非极性分子,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,等电子体结构相似,根据价层电子对互斥理论确定其空间构型;
(2)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(3)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
(6)Cu3N的晶胞结构如图,大球个数=12×
=3,小球个数=
=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,Cu3N的密度=
.
(2)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(3)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
(6)Cu3N的晶胞结构如图,大球个数=12×
| 1 |
| 4 |
| 1 |
| 8 |
| m |
| V |
解答:
解:(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,得电子体结构相似,亚硝酸根离子中N原子价层电子对个数=2+
×(5+1-2×2)=3且含有一个孤电子对,所以为V形结构,
故答案为:二;VA;V形;
(2)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(3)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,
故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为 ,故答案为:
,故答案为: ;
;
(6)Cu3N的晶胞结构如图,大球个数=12×
=3,小球个数=
=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=
=
g/cm3=
g/cm3,
故答案为:6;
.
| 1 |
| 2 |
故答案为:二;VA;V形;
(2)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(3)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,
故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为
 ,故答案为:
,故答案为: ;
;(6)Cu3N的晶胞结构如图,大球个数=12×
| 1 |
| 4 |
| 1 |
| 8 |
| m |
| V |
| ||
| [(2a+2b)×10 -10]3 |
| 1.03×1032 |
| 4(a+b)3N A |
故答案为:6;
| 1.03×1032 |
| 4(a+b)3N A |
点评:本题考查了物质结构和性质,涉及晶胞的计算、原子杂化、核外电子排布等知识点,根据密度公式、价层电子对互斥理论、构造原理等知识点来分析解答,这些知识点都是考试热点,难点是晶胞的计算,明确各个字母的含义,注意(1)中采用知识迁移的方法进行解答,题目难度中等.

练习册系列答案
相关题目
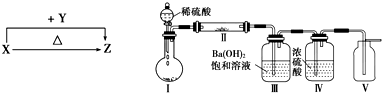
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )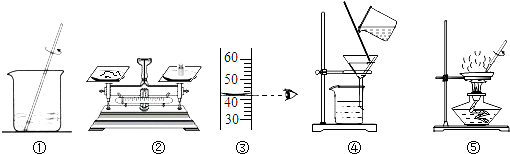

| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿包Cr3+.下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺檄性气味.
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺檄性气味.
| A、②④⑤ | B、②③ | C、①③ | D、①④ |
下列关于乙烯和聚乙烯的叙述不正确的是( )
| A、乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B、乙烯的化学性质比聚乙烯活泼 |
| C、取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D、取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
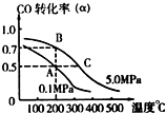 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |
| B、足量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.3NA |
| C、常温常压下,18g H2O含有的电子总数为8NA |
| D、标准状况下,22.4L的己烯中含有的分子数为NA |
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.