题目内容
下列有关化学用语使用正确的是( )
A、硫离子的原子结构示意图  | ||
| B、氯离子的电子式:Cl- | ||
C、原子核内有10个中子的氧原子:
| ||
| D、二氧化硫溶于水的反应化学方程式:SO2+H2O═H2SO4 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
B.氯离子为阴离子,电子式中需要标出最外层所带电荷;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角表示质子数;
D.二氧化硫与水反应生成亚硫酸,不会生成硫酸.
B.氯离子为阴离子,电子式中需要标出最外层所带电荷;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角表示质子数;
D.二氧化硫与水反应生成亚硫酸,不会生成硫酸.
解答:
解:A.硫离子的核电荷数为16,最外层含有8个电子,硫离子正确的结构示意图为: ,故A错误;
,故A错误;
B.氯离子为阴离子,电子式中需要标出其最外层电子,氯离子正确的电子式为: ,故B错误;
,故B错误;
C.原子核内有10个中子的氧原子的质量数为18,该原子可以表示为:
O,故C正确;
D.二氧化硫溶于水生成亚硫酸,正确的化学方程式为:SO2+H2O═H2SO3,故D错误;
故选C.
 ,故A错误;
,故A错误;B.氯离子为阴离子,电子式中需要标出其最外层电子,氯离子正确的电子式为:
 ,故B错误;
,故B错误;C.原子核内有10个中子的氧原子的质量数为18,该原子可以表示为:
18 8 |
D.二氧化硫溶于水生成亚硫酸,正确的化学方程式为:SO2+H2O═H2SO3,故D错误;
故选C.
点评:本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握离子结构示意图、电子式、元素符号等化学用语的概念及书写原则,试题培养了学生灵活应用基础知识的能力和规范答题能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列反应的离子方程式不正确的是( )
| A、锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu |
| B、氢氧化钠溶液与盐酸反应:OH-+H+=H2O |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
常用的电池是一个液体电解质将两个固体电极隔开.而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法不正确的是( )
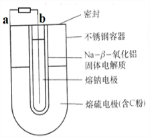

| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
下列粒子中,与OH-具有相同质子数和电子数的是( )
| A、Cl- |
| B、F- |
| C、NH3 |
| D、NH4+ |
现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a,则碳的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24 L SO2中约含有0.1NA个分子 |
| B、常温常压下,32g氧气和32g臭氧所含氧原子总数为2NA |
| C、18g D2O所含有的电子数为10NA |
| D、5.6gFe与足量Cl2反应转移的电子数为0.2NA |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1.0L1.0mol/L的Na2SO4水溶液中含有的氧原子数为4NA |
| B、1molNa2O2固体中含离子总数与1molCH4中所含共价键数目相等 |
| C、1molNaClO中所有ClO-的电子总数为26NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA |
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示.下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示.下列说法不正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 |
| B、状态A与状态B相比,状态A的c(I2)大 |
| C、若反应进行到状态D时,一定有V正>V逆 |
| D、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?moL-1,一段时间后达平衡,反应过程中测定的部分数据见下表:下列说法不正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A、反应在前5min的平均速率为v (SO2)=0.08mol?L-1?min-1 |
| B、保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) |
| C、该温度,反应的平衡常数为11.25L?mol-1 |
| D、相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |