题目内容
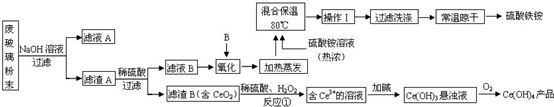
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性.
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4)3?b(NH4)2SO4?cH2O]广泛用于水的净化处理.
(1)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: .
(2)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号).
(3)写出反应①的化学方程式 .
(4)用滴定法测定制得的Ce(OH)4产品纯度.

滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 .(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应.则该硫酸铁铵的化学式为 .

已知:
ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性.
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4)3?b(NH4)2SO4?cH2O]广泛用于水的净化处理.
(1)操作Ⅰ的名称是
(2)反应①之前先要洗涤滤渣B,其目的是为了除去
(3)写出反应①的化学方程式
(4)用滴定法测定制得的Ce(OH)4产品纯度.

滴定时所用定量仪器的读数精确为
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应.则该硫酸铁铵的化学式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;
(2)固体表面可吸附Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2;
(4)滴定时所用定量仪器的最小刻度为0.1ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大;
(5)依据铁元素守恒计算氢氧化铁物质的量,依据硫酸根离子守恒和足量守恒计算分析化学式.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;
(2)固体表面可吸附Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2;
(4)滴定时所用定量仪器的最小刻度为0.1ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大;
(5)依据铁元素守恒计算氢氧化铁物质的量,依据硫酸根离子守恒和足量守恒计算分析化学式.
解答:
解:废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,检验硫酸铁铵溶液中含有NH4+,方法为取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,
故答案为:冷却结晶; 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,试纸变蓝色,证明含有NH4+;
(2)滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)滴定时所用定量仪器的最小刻度为0.1mL,估读0.01ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏大;
故答案为:0.1mL;偏大;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)
=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3?2(NH4)2SO4?2H2O,
故答案为:Fe2(SO4)3?2(NH4)2SO4?2H2O.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,检验硫酸铁铵溶液中含有NH4+,方法为取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,
故答案为:冷却结晶; 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,试纸变蓝色,证明含有NH4+;
(2)滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)滴定时所用定量仪器的最小刻度为0.1mL,估读0.01ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏大;
故答案为:0.1mL;偏大;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)
| 1.6g |
| 160g/mol |
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
| 0.72g |
| 18g/mol |
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3?2(NH4)2SO4?2H2O,
故答案为:Fe2(SO4)3?2(NH4)2SO4?2H2O.
点评:本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,题目难度较大.

练习册系列答案
相关题目
下列化学用语的表达或使用正确的是( )
A、氟离子的结构示意图: |
B、CH4的比例模型: |
C、羧基的电子式: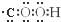 |
| D、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、稀盐酸 |
| C、硝酸铜 | D、氢氧化钠 |
在日常生活中会接触到许多物质.下列物质中属于酸性氧化物的是( )
| A、硫酸铵 | B、水 |
| C、二氧化碳 | D、氧化铜 |
下列化学工业有关设备、原料、反应条件配套的是( )
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
下列化学方程式或离子方程式中,正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2OH
| |||
B、水杨酸( )中加入NaHCO3溶液: )中加入NaHCO3溶液: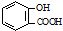 +2HCO3→ +2HCO3→ +2CO2↑+2H2O +2CO2↑+2H2O | |||
| C、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ |
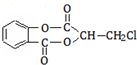 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去).
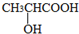 )经过几步有机反应制得,其中最佳的次序是:
)经过几步有机反应制得,其中最佳的次序是:
