题目内容
 实验室制取乙炔的实验装置图(如图)中,
实验室制取乙炔的实验装置图(如图)中,(1)A仪器的名称为
(2)将反应产生的乙炔通入酸性高锰酸钾溶液中,观察到的现象是:
(3)生成的乙炔中可能含有的杂质气体是
考点:乙炔炔烃
专题:有机物的化学性质及推断
分析:(1)熟悉常见仪器的名称,碳化钙与水反应生成乙炔;
(2)依据乙炔中含有碳碳三键,能发生与溴发生加成反应,具有还原性,能使高锰酸钾褪色解答;
(3)电石主要成分是CaC2,还有杂质CaS Ca3P2等,这些杂质CaS Ca3P2也能和水反应,生成H2S,PH3等杂质,可以用硫酸铜溶液除去.
(2)依据乙炔中含有碳碳三键,能发生与溴发生加成反应,具有还原性,能使高锰酸钾褪色解答;
(3)电石主要成分是CaC2,还有杂质CaS Ca3P2等,这些杂质CaS Ca3P2也能和水反应,生成H2S,PH3等杂质,可以用硫酸铜溶液除去.
解答:
解:(1)A仪器的名称为,碳化钙与水反应生成乙炔,反应非常剧烈,为了减慢反应的速率,通常用饱和食盐水与碳化钙反应,发生的反应方程式为:
CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:分液漏斗;饱和食盐水; CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔中含有碳碳三键,具有还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色,乙炔为不饱和烃与溴能1:1加成生成1,2-二溴乙烯,化学方程式为:
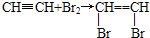 ,
,
故答案为:酸性高锰酸钾溶液紫色褪去;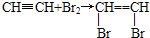 ;
;
(3)电石主要成分是CaC2 ,还有杂质CaS Ca3P2等,这些杂质CaS、Ca3P2也能和水反应,生成H2S,PH3等杂质,H2S,PH3都与硫酸铜溶液发生反应而除去,故可以用硫酸铜溶液除去杂质;
故答案为:硫化氢、磷化氢(H2S、PH3);将混合气体通过CuSO4溶液洗气.
CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:分液漏斗;饱和食盐水; CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔中含有碳碳三键,具有还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色,乙炔为不饱和烃与溴能1:1加成生成1,2-二溴乙烯,化学方程式为:
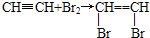 ,
,故答案为:酸性高锰酸钾溶液紫色褪去;
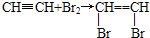 ;
;(3)电石主要成分是CaC2 ,还有杂质CaS Ca3P2等,这些杂质CaS、Ca3P2也能和水反应,生成H2S,PH3等杂质,H2S,PH3都与硫酸铜溶液发生反应而除去,故可以用硫酸铜溶液除去杂质;
故答案为:硫化氢、磷化氢(H2S、PH3);将混合气体通过CuSO4溶液洗气.
点评:本题考查了乙炔的实验室制法和性质,明确乙炔的结构和性质是解题的关键,注意相关知识的积累.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
医学研究证明,用放射性
I治疗肿瘤可收到一定疗效,下列有关
I叙述正确的是( )
135 53 |
135 53 |
A、
| ||
B、
| ||
C、
| ||
D、
|
用图所示装置进行实验,不能达到实验目的是( )
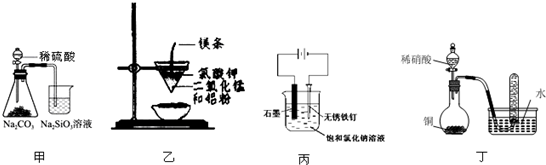

| A、用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B、用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C、用丙装置可实现对铁钉的保护 |
| D、用丁装置验证铜与稀硝酸反应的气体产物只有NO |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.