题目内容
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 .
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As Se(填“>”、“<”或“=”).
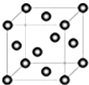
②硫化锌的晶胞中(结构如图1所示),其化学式是 .
③二氧化硒(SeO2)分子的空间构型为 .
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图2,请在上图中用箭头表示出配位键.(请用以镁为中心连接的四个氮原子为骨架作图即可)
(4)水分子间因存在“氢键”的作用而彼此结合形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图3所示,试填空:
①1mol冰中有 mol“氢键”.
②H2O的沸点比H2S高的原因是 .

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As
②硫化锌的晶胞中(结构如图1所示),其化学式是
③二氧化硒(SeO2)分子的空间构型为
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图2,请在上图中用箭头表示出配位键.(请用以镁为中心连接的四个氮原子为骨架作图即可)
(4)水分子间因存在“氢键”的作用而彼此结合形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图3所示,试填空:
①1mol冰中有
②H2O的沸点比H2S高的原因是
考点:原子核外电子排布,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,晶胞的计算,含有氢键的物质
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)镍是28号元素,原子核外有28个电子,根据构造原理书写基态镍原子的核外电子排布式的简化形式;
(2)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,注意第VA族元素大于同周期相邻元素的第一电离能;
②根据均摊法推断化学式;
③根据价层电子对互斥理论确定其空间构型;
(3)配位键由提供孤电子对的原子指向提供空轨道的原子;
(4)①该分子形成的晶体中每个H2O分子通过氢键与4个H2O分子理解,每个氢键为H2O分子提供
;
②存在氢键沸点升高.
(2)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,注意第VA族元素大于同周期相邻元素的第一电离能;
②根据均摊法推断化学式;
③根据价层电子对互斥理论确定其空间构型;
(3)配位键由提供孤电子对的原子指向提供空轨道的原子;
(4)①该分子形成的晶体中每个H2O分子通过氢键与4个H2O分子理解,每个氢键为H2O分子提供
| 1 |
| 2 |
②存在氢键沸点升高.
解答:
解:(1)镍是28号元素,原子核外有28个电子,根据构造原理基态Ni原子核外电子排布式为1S22S22P63S23P63d84s2,
故答案为1S22S22P63S23P63d84s2;
(2)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,As原子4p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于Se,所以第一电离能As>Se,故答案为:>;
②由晶胞结构可知,锌原子位于体内,共4个为晶胞共有,硫原子位于顶点和面心,晶胞中含硫原子:
×8+
×6=4,故硫化锌的化学式为:ZnS,故答案为:ZnS;
③二氧化硒分子中Se原子价层电子对=2+
=3,且含有一个孤电子对,所以其空间结构为V形,故答案为:V形;
(3)配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为:
 ,故答案为:
,故答案为: ;
;
(4)①该分子形成的晶体中每个H2O分子通过氢键与4个H2O分子理解,每个氢键为H2O分子提供
,所以含1molH2O的该晶体中有 1mol×4×
=2mol“氢键”,故答案为:2;
②H2O中存在氢键,常温下为液体,所以沸点H2O>H2S,故答案为:H2O分子之间存在氢键作用.
故答案为1S22S22P63S23P63d84s2;
(2)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,As原子4p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于Se,所以第一电离能As>Se,故答案为:>;
②由晶胞结构可知,锌原子位于体内,共4个为晶胞共有,硫原子位于顶点和面心,晶胞中含硫原子:
| 1 |
| 8 |
| 1 |
| 2 |
③二氧化硒分子中Se原子价层电子对=2+
| 6-2×2 |
| 2 |
(3)配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为:
 ,故答案为:
,故答案为: ;
;(4)①该分子形成的晶体中每个H2O分子通过氢键与4个H2O分子理解,每个氢键为H2O分子提供
| 1 |
| 2 |
| 1 |
| 2 |
②H2O中存在氢键,常温下为液体,所以沸点H2O>H2S,故答案为:H2O分子之间存在氢键作用.
点评:本题是对物质结构的考查,涉及核外电子排布、杂化轨道、分子结构与性质、氢键、配合物等,难度中等,会利用均摊法进行晶胞有关计算,注意配位键形成条件.

练习册系列答案
相关题目
核电荷数为15的原子,n层电子个数最多,n层为( )
| A、K层 | B、N层 | C、M层 | D、L层 |
下列各组元素的原子,其中最外层电子数相同的是( )
| A、氮和磷 | B、碳和硫 |
| C、钠和铝 | D、氟和氖 |
下列说法中正确的是( )
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.