题目内容
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)Ge的原子核外电子排布式为 .
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 .
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 , (写出2条即可).
(4)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为 .
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 .
(A)强 (B)弱 (C)相等 (D)无法判断.
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式
②SiO2晶体的空间构型及硅氧之间的成键方式
③已知SnO2是离子晶体,写出其主要物理性质
(4)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度
(A)强 (B)弱 (C)相等 (D)无法判断.
考点:原子核外电子排布,化学键,判断简单分子或离子的构型
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)Ge是32号元素,其原子核外有32 个电子,根据构造原理书写其基态原子核外电子排布式;
(2)金属元素能形成金属晶体;
(3)①根据价层电子对互斥理论确定其空间构型,非金属元素之间易形成共价键;
②二氧化硅是原子晶体,每个硅原子和4个氧原子之间形成4个共价键,每个氧原子和2个硅原子形成2个共价键;非金属元素之间易形成共价键;
③熔融状态下,离子晶体能电离出阴阳离子,离子晶体的熔点与其晶格能成正比;
(4)含有空轨道和孤电子对的原子之间易形成配位键;
(5)碳氧键的红外伸缩振动频率与键的强度成正比.
(2)金属元素能形成金属晶体;
(3)①根据价层电子对互斥理论确定其空间构型,非金属元素之间易形成共价键;
②二氧化硅是原子晶体,每个硅原子和4个氧原子之间形成4个共价键,每个氧原子和2个硅原子形成2个共价键;非金属元素之间易形成共价键;
③熔融状态下,离子晶体能电离出阴阳离子,离子晶体的熔点与其晶格能成正比;
(4)含有空轨道和孤电子对的原子之间易形成配位键;
(5)碳氧键的红外伸缩振动频率与键的强度成正比.
解答:
解:(1)Ge是32号元素,其原子核外有32 个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d104s24p2,
故答案为:1s22s22p63s23p63d104s24p2;
(2)金属元素能形成金属晶体,所以能形成金属晶体的是Sn,故答案为:Sn;
(3)①二氧化碳分子中碳原子价层电子对个数是2,且不含孤电子对,所以其空间构型是直线形,碳原子和氧原子之间存在共价键,故答案为:直线形,共价键;
②二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,硅原子和氧原子之间存在共价键,
故答案为:Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,共价键;
③离子晶体在熔融状态下能电离呈自由移动的阴阳离子而导电,且离子晶体一般有较高的熔点,故答案为:熔融时能导电;较高的熔点;
(4)镍原子中含有空轨道、CO中含有孤电子对,所以二者能形成配位键,故答案为:配位键;
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度与CO分子中碳氧键的强度弱,故选B.
故答案为:1s22s22p63s23p63d104s24p2;
(2)金属元素能形成金属晶体,所以能形成金属晶体的是Sn,故答案为:Sn;
(3)①二氧化碳分子中碳原子价层电子对个数是2,且不含孤电子对,所以其空间构型是直线形,碳原子和氧原子之间存在共价键,故答案为:直线形,共价键;
②二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,硅原子和氧原子之间存在共价键,
故答案为:Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,共价键;
③离子晶体在熔融状态下能电离呈自由移动的阴阳离子而导电,且离子晶体一般有较高的熔点,故答案为:熔融时能导电;较高的熔点;
(4)镍原子中含有空轨道、CO中含有孤电子对,所以二者能形成配位键,故答案为:配位键;
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度与CO分子中碳氧键的强度弱,故选B.
点评:本题考查了物质结构和性质,涉及知识点较多,这些知识点都是考试热点,知道配位键的形成条件、核外电子排布式的书写规则、价层电子对互斥理论的运用等知识点即可解答,知道计算价层电子对个数的方法,明确各个字母的含义,为学习难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
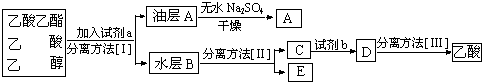
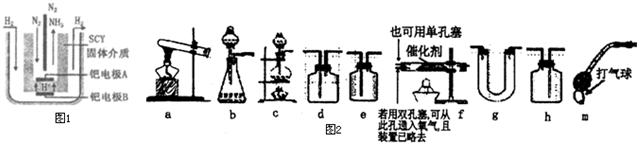




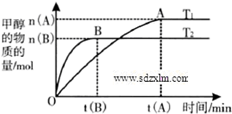 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.