题目内容
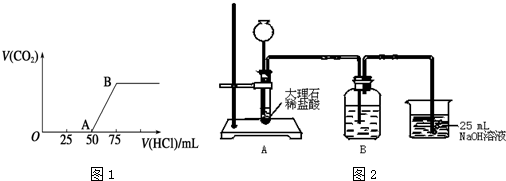
16.Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3 (s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至5.分析 Cr(OH)3的溶度积Ksp=10-32=c(Cr3+)•c(OH-)3,要使c(Cr3+)完全沉淀,应使c(Cr3+)降至10-5 mol/L,根据溶度积常数以及水的离子积常数来进行计算.
解答 解:Cr(OH)3的溶度积Ksp=10-32=c(Cr3+)•c(OH-)3,当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1.0×1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9 mol/L,c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5.
点评 本题考查沉淀溶解平衡和Ksp的有关计算,为高频考点,侧重于反应原理的应用的考查,注意把握计算公式的运用,题目难度不大.

练习册系列答案
相关题目
6.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
反应试剂、产物的物理常数:
主要实验装置和流程如图1、2:
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程(图3)分离出苯甲酸和回收未反应的甲苯.
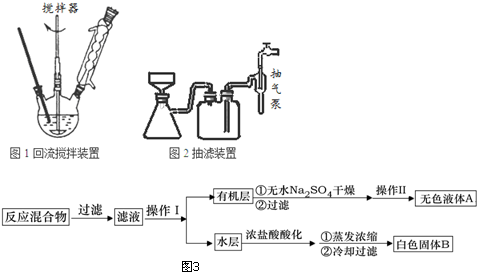
(1)无色液体A的结构简式为 ;操作Ⅱ为蒸馏.
;操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
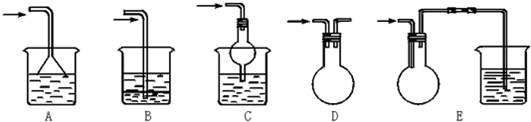
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.

反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程(图3)分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为
 ;操作Ⅱ为蒸馏.
;操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
4.甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是提高甲醇的转化率.
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:

请回答下列问题:
①如图中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池正极的电极反应式为O2+2H2O-4e-=4OH-.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为3.2g.
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由右图可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是提高甲醇的转化率.
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |

请回答下列问题:
①如图中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池正极的电极反应式为O2+2H2O-4e-=4OH-.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由右图可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
5.下列物质各3g,在氧气中完全燃烧,于150℃时将产物通过足量的Na2O2固体后,固 体增重大于3g的是( )
| A. | HCOOH | B. | CH3COOH | C. | C2H5OH | D. | C6H12O6 |
6.下列离子方程式,书写正确的是( )
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓ | |
| D. | 盐酸跟氢氧化镁反应:H++OH-═H2O |