题目内容
4.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO→Na2CO3+2HclO | |
| B. | HCN+Na2CO3→CO2+2NaCN+H2O | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数比较:Ki1(H2CO3)>Ki2(H2CO3)>Ki(C6H5OH) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,据此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中发生的反应为:NaClO+CO2+H2O=NaHCO3+HClO,故A错误;
B.酸性HCO3-<HCN<H2CO3,所以过量的HCN滴入碳酸钠溶液中发生反应:HCN+Na2CO3=NaCN+NaHCO3,故B错误;
C.酸根离子水解程度越大,其结合质子能力越强,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根离子结合质子能力大小顺序是CO32->CN->HCO3->CH3COO-,故C正确;
D.酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D错误;
故选C.
点评 本题考查了盐类水解,明确酸根离子水解程度与酸的电离平衡常数、相同浓度钠盐溶液pH大小的关系是解本题关键,再结合强酸制取弱酸来分析解答,题目难度中等.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
15.下列有关说法正确的是( )
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度不同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
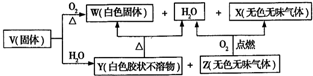
12.X、Y、Z三种物质均含某种元素,箭头表示物质间的转化一步就能实现,则X不可能是( )


| A. | SiO2 | B. | CO2 | C. | Na | D. | HNO3 |
9.下列操作可得纯净Al2O3的是( )
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
16.已知酸性条件下有如下反应:2Cu+═Cu2++Cu.由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
由此推出本次氢气还原氧化铜实验的产物是( )
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
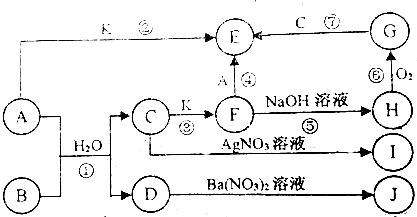
13.A~K为中学化学的常见物质,他们之间有如图所示的转化关系.(其中部分反应产物和反应条件已略去).已知,通常状况下,A是一种黄绿色的非金属单质;B是一种有刺激性气味的气体,且有漂白性.C和D是中学化学中常见的两种强酸,I和J不溶于水也不溶于稀硝酸;K为金属单质.
回答下列问题:
(1)写出物质B和I的化学式:BSO2,IAgCl.
(2)反应④的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(3)反应⑥的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)检验E中阳离子的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)对气体A进行如下检验,已知整个反应过程中,每消耗0.1molKI,转移电子数3.612×1023个.按要求填空.

回答下列问题:
(1)写出物质B和I的化学式:BSO2,IAgCl.
(2)反应④的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(3)反应⑥的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)检验E中阳离子的方法是取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+.
(5)对气体A进行如下检验,已知整个反应过程中,每消耗0.1molKI,转移电子数3.612×1023个.按要求填空.
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |