题目内容
12.在25℃时,浓度均为1mol/L的醋酸钠(CH3COONa)、碳酸钠(Na2CO3)、苯酚钠(C6H5ONa)的溶液,测得其pH值分别为a、b、c,下列判断正确的是( )| A. | a=b=c | B. | a>b>c | C. | b>c>a | D. | c>b>a |
分析 盐溶液中弱酸阴离子水解溶液显碱性,酸性越强对应盐水解程度越小,碱性越小,CH3COOH>H2CO3>C6H5OH>HCO3-,对应盐水解程度CH3COO-<HCO3-<C6H5O-<CO32-,据此分析判断溶液PH.
解答 解:酸性强弱顺序为:CH3COOH>H2CO3>C6H5OH>HCO3-,对应盐水解程度CH3COO-<HCO3-<C6H5O-<CO32-,水解程度越大溶液PH越大,在25℃时,浓度均为1mol/L的醋酸钠(CH3COONa)、碳酸钠(Na2CO3)、苯酚钠(C6H5ONa)的溶液,测得其pH值分别为a、b、c,b>c>a,
故选C.
点评 本题考查盐类水解、pH的大小比较等,侧重于学生的分析能力和基本理论的理解和运用的考查,为高考常见题型和高频考点,明确盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度中等.

练习册系列答案
相关题目
12.下列关于碱金属元素的性质,说法不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多,原子半径逐渐增大 | |
| B. | 从上到下,对应单质的颜色随着核电荷数的增加而加深 | |
| C. | 从上到下,随着核电荷数的增加,对应单质与水反应的剧烈程度逐渐增大 | |
| D. | 从上到下,随着核电荷数的增加,对应单质的熔、沸点都逐渐减小 |
10.下列涉及有机物的说法正确的是( )
| A. | 乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料 | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 酒越陈越香是因为酒中含有的有机酸与乙醇生成了酯 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
7.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法中正确的是( )
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
17.将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是( )
| A. | 若反应中转移的电子为n mol,则n一定大于0.15 mol | |
| B. | n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(Na+):n(Cl-) 可能为7:3 |
4.在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是( )
| A. | HCO3- | B. | NO3- | C. | NH${\;}_{4}^{+}$ | D. | Al3+ |
1.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
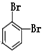 和
和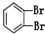 ④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.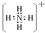 .
.