题目内容
1.下列说法正确的是( )| A. | 蔗糖与纤维素均属于高分子化合物 | |
| B. | 不同的油脂发生皂化反应,至少有一种产物相同 | |
| C. | 淀粉在稀硫酸作用下充分加热后,所得溶液与少量新制Cu(OH)2共热未见红色沉淀,说明淀粉未发生水解 | |
| D. | 蛋白质溶液中加入酒精后会发生盐析而失去生理活性 |
分析 A.相对分子质量在10000以上的为高分子;
B.油脂为高级脂肪酸甘油酯;
C.淀粉水解生成葡萄糖,检验葡萄糖应在碱性条件下;
C.酒精能使蛋白质发生变性.
解答 解:A.相对分子质量在10000以上的为高分子,则纤维素属于高分子化合物,而蔗糖不是,故A错误;
B.油脂为高级脂肪酸甘油酯,碱性条件下发生水解反应为皂化反应,均生成甘油,故B正确;
C.淀粉水解生成葡萄糖,检验葡萄糖应在碱性条件下,则没有加碱至碱性,不能与制Cu(OH)2共热出现红色沉淀,故C错误;
C.酒精能使蛋白质发生变性,为不可逆过程,失去生理活性,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握基本营养物质的性质、高分子判断、有机物的检验实验为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
11.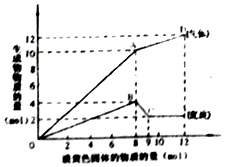 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
12. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )| A. | 溶液中OH-、导线中的电子都向电极a移动 | |
| B. | N2在正极生成 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 电极b的反应式为O2+4H++4e-=2H2O |
9.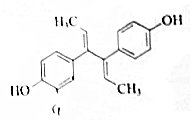 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )| A. | 分子式为C18H18O2,可溶于氯仿或氢氧化钠溶液 | |
| B. | 双烯雌酚既可发生加聚反应,也可以发生缩聚反应 | |
| C. | 其苯环上的二氯代物有7种 | |
| D. | 1 mol双烯雌酚跟H2反应,最多可消耗8mol H2. |
16.室温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合后溶液呈酸性,则:c(HSO3-)>c(SO32-) | |
| B. | 0.1mol•L-1的CH3COONa溶液20mL与0.1mol•L-1的稀盐酸10mL混合后溶液显酸性:c(CH3COO-)>c (Cl-)>c(H+)>c(CH3COOH) | |
| C. | c(NH4+)浓度相同的NH4Cl、(NH4)2SO4、(NH4)2CO3溶液中,溶质的物质的量浓度:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) | |
| D. | 0.1mol•L-1NaNO3溶液与0.1mol•L-1CH3COOH溶液以任意比例混合:c(H+)=c(OH-)+c(CH3COO-) |
5.硫代硫酸钠是一种常见的化工原料.将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,该反应的化学方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_赶走水中的溶解氧(或空气)_.
(2)用该方法获得的Na2S2O3•5H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质的成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】假设1:晶体中只含Na2CO3杂质; 假设2:晶体中只含Na2S杂质;
假设3:晶体中含Na2S和Na2CO3两种杂质.
【查阅资料】①SO2+2H2S═3S↓+2H2O;
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.
③H2S+CuSO4═CuS↓(黑色)+H2SO4
【判断与思考】某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?不合理(填“合理”或“不合理”),请说明理由:Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出.
【设计方案进行实验】基于假设1,完成下表中的实验方案、现象及结论(仪器自选).限选实验试剂:3mol•L-1 H2SO4溶液、1mol•L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水.
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6.为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol•L-1的碘水进行多次取样滴定,测得Na2S2O3•5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_赶走水中的溶解氧(或空气)_.
(2)用该方法获得的Na2S2O3•5H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质的成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】假设1:晶体中只含Na2CO3杂质; 假设2:晶体中只含Na2S杂质;
假设3:晶体中含Na2S和Na2CO3两种杂质.
【查阅资料】①SO2+2H2S═3S↓+2H2O;
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.
③H2S+CuSO4═CuS↓(黑色)+H2SO4
【判断与思考】某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?不合理(填“合理”或“不合理”),请说明理由:Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出.
【设计方案进行实验】基于假设1,完成下表中的实验方案、现象及结论(仪器自选).限选实验试剂:3mol•L-1 H2SO4溶液、1mol•L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水.
| 实验方案 | 现象及结论 |
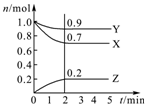 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得: