��Ŀ����
�����ü�����ˮ��Ӧ�Ʊ���������ԭ�ϼ��������ʸߣ�����ʵ���ƹ��ֵ����֪�÷�ӦΪ��
a��CH4��g��+H2O��g��?CO��g��+3H2��g����H=+206.2kJ/mol
b��CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol
��1��������Ӧ����ԭ�����е�CO��ʹ���ϳɴ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ�ֿ��Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2����800��ʱ����Ӧa��ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=2.0mol?L-1��c��H2O��=5.0mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.5mol?L-1�����ʱ���淴Ӧ���ʵĹ�ϵ��v�� �����������������=����v����
��3���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g���������÷�Ӧ���ش��������⣺
��һ�������£���CO��H2�������1��1���ں����ܱ������з������Ϸ�Ӧ����˵���÷�Ӧ�Ѵﵽƽ����� ��
a����ϵ��ѹǿ�������仯
b��CO��H2������ȱ��ֲ���
c����ϵ��̼Ԫ�ص������������ٱ仯
d����λʱ��������1mol CO��ͬʱ����lmol CH3OH
����ͼ1�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߣ�T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1 �����������������=���� K2�������ǣ� ��
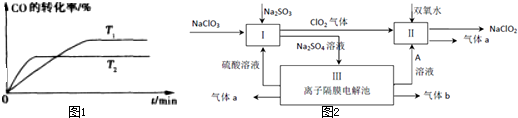
���������ƣ�NaClO2����һ��ǿ������Ư�����㷺���ڷ�֯��ӡȾ��ʳƷ��ҵ�����ڼ��Ի������ȶ����ڣ�ijͬѧ�������Ϻ��������NaClO2����Ҫ������ͼ2��
��4��A�Ļ�ѧʽ�� ��װ�â���A�� ���������������������������������a�ĵ缫��Ӧʽ ��
��5��װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ ��
a��CH4��g��+H2O��g��?CO��g��+3H2��g����H=+206.2kJ/mol
b��CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol
��1��������Ӧ����ԭ�����е�CO��ʹ���ϳɴ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ�ֿ��Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ��
��2����800��ʱ����Ӧa��ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=2.0mol?L-1��c��H2O��=5.0mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.5mol?L-1�����ʱ���淴Ӧ���ʵĹ�ϵ��v��
��3���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g���������÷�Ӧ���ش��������⣺
��һ�������£���CO��H2�������1��1���ں����ܱ������з������Ϸ�Ӧ����˵���÷�Ӧ�Ѵﵽƽ�����
a����ϵ��ѹǿ�������仯
b��CO��H2������ȱ��ֲ���
c����ϵ��̼Ԫ�ص������������ٱ仯
d����λʱ��������1mol CO��ͬʱ����lmol CH3OH
����ͼ1�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߣ�T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1

���������ƣ�NaClO2����һ��ǿ������Ư�����㷺���ڷ�֯��ӡȾ��ʳƷ��ҵ�����ڼ��Ի������ȶ����ڣ�ijͬѧ�������Ϻ��������NaClO2����Ҫ������ͼ2��
��4��A�Ļ�ѧʽ��
��5��װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,ԭ��غ͵��صĹ���ԭ��,��ѧƽ��״̬���ж�
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��,�绯ѧר��
��������1�����ݸ�˹���������Ȼ�ѧ����ʽ�ĺ��������㷴Ӧ���ʱ䣻
��2������Ũ���̺�ƽ�ⳣ���Ĺ�ϵ��ȷ���ƶ�����
��3���ٵ���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䣬�Դ˽����жϣ�
���ɴﵽƽ������Ҫ��ʱ�䳤��֪�¶ȵĴ�С��ϵ�������¶ȶ�ƽ���ƶ���Ӱ�����ش��жϣ�
��4������ͼ֪��III�е������Na2SO4�����Na2SO4��Һʱ�������ϵ缫��ӦʽΪ2H2O-4e-=O2��+4H+�������缫��ӦʽΪ2H2O+2e-=H2��+2OH-������a������������b������������A��NaOH���ݴ˷������
��2������Ũ���̺�ƽ�ⳣ���Ĺ�ϵ��ȷ���ƶ�����
��3���ٵ���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䣬�Դ˽����жϣ�
���ɴﵽƽ������Ҫ��ʱ�䳤��֪�¶ȵĴ�С��ϵ�������¶ȶ�ƽ���ƶ���Ӱ�����ش��жϣ�
��4������ͼ֪��III�е������Na2SO4�����Na2SO4��Һʱ�������ϵ缫��ӦʽΪ2H2O-4e-=O2��+4H+�������缫��ӦʽΪ2H2O+2e-=H2��+2OH-������a������������b������������A��NaOH���ݴ˷������
���
�⣺��a��CH4��g��+H2O��g��?CO��g��+3H2��g����H=+206.2kJ/mol
b��CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol��
��1�����ݸ�˹���ɣ���ӦCO��g��+H2O��g��?CO2��g��+H2��g��������b-a�õ���CO��g��+H2O��g��?CO2��g��+H2��g������H=165.0kJ/mol-206.2kJ/mol=-41.2 kJ/mol��
�ʴ�Ϊ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.2 kJ/mol��
��2��800��ʱ����Ӧ���ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=2.0mol?L-1��c��H2O��=5.0mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.5mol?L-1��
��Ũ����Ϊ��Qc=
=1.25��1����ѧ��Ӧ����������в��ܴﵽƽ�⣬����v����v����
�ʴ�Ϊ������
��3����a��CO��g��+2H2��g��?CH3OH��g����һ����Ӧǰ�����������С�ķ�Ӧ���ʵ�ѹǿ����ʱ������Ӧ�ﵽƽ�⣬��a��ȷ��
b��CO��H2������ȱ��ֲ���ʱ��˵��ƽ�ⲻ���ƶ�����b��ȷ��
c�����������غ㣬��ϵ��̼Ԫ�صİٷֺ�������仯����c����
d���κ�����£���λʱ��������1 mol CO��ͬʱ����l mol CH3OH����d����
�ʴ�Ϊ��ab��
���ɴﵽƽ������Ҫ��ʱ�䳤��֪��T1��T2�����¶���T2��T1�����£�ʱ��CO��ת��������˵�������¶�ʱƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ����H��0��K1��K2��
�ʴ�Ϊ��������ͼ���¶���T1������T2ʱ��CO��ת���ʽ��ͣ�˵��ƽ�����淴Ӧ�����ƶ�������K1��K2����
��4������ͼ֪��III�е������Na2SO4�����Na2SO4��Һʱ�������ϵ缫��ӦʽΪ2H2O-4e-=O2��+4H+�������缫��ӦʽΪ2H2O+2e-=H2��+2OH-������������ᣬ����a������������b������������A��NaOH��A�����������ɣ����������ĵ缫��ӦʽΪ2H2O-4e-=O2��+4H+��
�ʴ�Ϊ��NaOH������2H2O-4e-=O2��+4H+��
��5�����з�Ӧ����������Ϣ��֪������NaClO2������һ����ClO2��NaClO2�����ϼ۽��ͣ�����ԭ����H2O2�ض�����������������������Ӧ��ClO2����������������ԭ��Ӧ��H2O2�ǻ�ԭ��������������Ӧ�����ݵ���ת���غ��֪4n��ClO2��=n��HCl�������Է�Ӧ����ʽΪ��2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2����
�ʴ�Ϊ��2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2����
b��CH4��g��+2H2O��g��?CO2��g��+4H2��g����H=+165.0kJ/mol��
��1�����ݸ�˹���ɣ���ӦCO��g��+H2O��g��?CO2��g��+H2��g��������b-a�õ���CO��g��+H2O��g��?CO2��g��+H2��g������H=165.0kJ/mol-206.2kJ/mol=-41.2 kJ/mol��
�ʴ�Ϊ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.2 kJ/mol��
��2��800��ʱ����Ӧ���ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=2.0mol?L-1��c��H2O��=5.0mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.5mol?L-1��
��Ũ����Ϊ��Qc=
| 2.0��2��52 |
| 2.0��5.0 |
�ʴ�Ϊ������
��3����a��CO��g��+2H2��g��?CH3OH��g����һ����Ӧǰ�����������С�ķ�Ӧ���ʵ�ѹǿ����ʱ������Ӧ�ﵽƽ�⣬��a��ȷ��
b��CO��H2������ȱ��ֲ���ʱ��˵��ƽ�ⲻ���ƶ�����b��ȷ��
c�����������غ㣬��ϵ��̼Ԫ�صİٷֺ�������仯����c����
d���κ�����£���λʱ��������1 mol CO��ͬʱ����l mol CH3OH����d����
�ʴ�Ϊ��ab��
���ɴﵽƽ������Ҫ��ʱ�䳤��֪��T1��T2�����¶���T2��T1�����£�ʱ��CO��ת��������˵�������¶�ʱƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ����H��0��K1��K2��
�ʴ�Ϊ��������ͼ���¶���T1������T2ʱ��CO��ת���ʽ��ͣ�˵��ƽ�����淴Ӧ�����ƶ�������K1��K2����
��4������ͼ֪��III�е������Na2SO4�����Na2SO4��Һʱ�������ϵ缫��ӦʽΪ2H2O-4e-=O2��+4H+�������缫��ӦʽΪ2H2O+2e-=H2��+2OH-������������ᣬ����a������������b������������A��NaOH��A�����������ɣ����������ĵ缫��ӦʽΪ2H2O-4e-=O2��+4H+��
�ʴ�Ϊ��NaOH������2H2O-4e-=O2��+4H+��
��5�����з�Ӧ����������Ϣ��֪������NaClO2������һ����ClO2��NaClO2�����ϼ۽��ͣ�����ԭ����H2O2�ض�����������������������Ӧ��ClO2����������������ԭ��Ӧ��H2O2�ǻ�ԭ��������������Ӧ�����ݵ���ת���غ��֪4n��ClO2��=n��HCl�������Է�Ӧ����ʽΪ��2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2����
�ʴ�Ϊ��2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2����
���������⿼���˵��ԭ�����Ȼ�ѧ����ʽ����д����ѧƽ��״̬���жϵ�֪ʶ����Ŀ�Ѷ��еȣ����������ϴ��ۺ��Խ�ǿ��֪ʶ�㸲��ȫ�棬ע������ԭ��ع���ԭ������ȷ�Ȼ�ѧ����ʽ����д��������ѧƽ��״̬���������жϷ���������������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������

��ϰ��ϵ�д�
 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
�����Ŀ
 ����ͼװ�õ��Թ��м���ij�����ʺ�U�ι��ұ�֧�ܵĺ�īˮҺ�潵�ͣ����֧�ܵĺ�īˮҺ�������������������ǣ�������
����ͼװ�õ��Թ��м���ij�����ʺ�U�ι��ұ�֧�ܵĺ�īˮҺ�潵�ͣ����֧�ܵĺ�īˮҺ�������������������ǣ�������| A���������� | B������� |
| C��Ũ���� | D����ʯ�� |
��Ԫ�����ڱ���̼Ԫ�ص���Ϣ��ͼ��ʾ������˵����ȷ���ǣ�������


| A��̼ԭ���е�������Ϊ6 |
| B��̼�����ԭ��������12.01g |
| C��̼���ڽ���Ԫ�� |
| D��̼��������ֻ��һ�� |
��֪��Ӧ��
��2C��s��+O2��g��=2CO��g����H=-221kJ?mol-1
��H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ?mol-1
���н��۴�����ǣ�������
��2C��s��+O2��g��=2CO��g����H=-221kJ?mol-1
��H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ?mol-1
���н��۴�����ǣ�������
| A��̼��ȼ���ȴ���110.5kJ?mol-1 |
| B���ٵķ�Ӧ��Ϊ-221kJ?mol-1 |
| C��ϡ�����ϡNaOH��Һ��Ӧ����1molH2O���ų�57.3 kJ������ |
| D��ϡH2SO4 ��ϡNaOH��Һ��Ӧ���к���Ϊ57.3 kJ?mol-1 |
��Ca��OH��2��������ˮ�У�һ��ʱ���ﵽƽ�⣺Ca��OH��2��s��?Ca2++2OH-��������Һ�м���������ʯ�Һ����¶ȱ��ֲ��䣬����˵����ȷ���ǣ�������
| A����Һ��Ca2+��Ŀ���� |
| B����Һ��Ca2+��Ŀ���� |
| C��c��Ca2+������ |
| D��c��Ca2+������ |


 ��һ�������¿�ˮ��Ϊ
��һ�������¿�ˮ��Ϊ ��R2-NH2��H��һ��������ˮ��IJ���֮һΪ������M������M�γɶ��ĵĻ�ѧ����ʽΪ
��R2-NH2��H��һ��������ˮ��IJ���֮һΪ������M������M�γɶ��ĵĻ�ѧ����ʽΪ ij��ȤС��ͬѧ��ͬ��������ͼ��ʾ��ʵ��װ�ã�����������ȡ���壬�ֿ�������֤���ʵ����ʣ���ش��������⣺
ij��ȤС��ͬѧ��ͬ��������ͼ��ʾ��ʵ��װ�ã�����������ȡ���壬�ֿ�������֤���ʵ����ʣ���ش��������⣺