题目内容
7.0.4g Na0H溶于水配成100mL溶液.c(OH-)0.1mol/L,c(H+)=1×10-13mol/L,pH=13,从该溶液中取出10mL,pH=13.分析 先根据n=$\frac{m}{M}$计算出0.4g氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出氢氧化钠的浓度,从而可知氢氧根离子浓度;然后结合水的离子积计算出该溶液中氢离子浓度,再根据pH=-lgc(H+)计算出其pH;溶液具有均一性,则取出的溶液pH不变,据此进行解答.
解答 解:0.4g氢氧化钠的物质的量为:$\frac{0.4g}{40g/mol}$=0.01mol,该溶液的浓度为:$\frac{0.01mol}{0.1L}$=0.1mol/L,NaOH为强电解质,则氢氧根离子浓度为0.1mo/L;
该溶液中氢离子浓度为:c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L,该溶液的pH═-lgc(H+)=13;
溶液具有均一性,则从该溶液中取出10mL,取出溶液的pH仍然为13,
故答案为:0.1mol/L;1×10-13mol/L;13;13.
点评 本题考查了溶液pH的计算、溶液性质,题目难度不大,明确溶液酸碱性与溶液pH的计算方法为解答关键,注意溶液具有均一性的特点,试题培养了学生的化学计算能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
17.下列操作或装置能达到实验目的是( )
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |
18.下列说法中正确的是( )
| A. | 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-═AgI↓ | |
| B. | NH4+的水解反应离子方程式:NH4++H2O?NH3•H2O+H+ | |
| C. | 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu | |
| D. | 某反应△H<0,则该反应在任意条件下均可自发进行 |
15.某饱和一元醇的结构简式如下,其系统命名是( )


| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
4.25℃时,有关物质的电离平衡常数如下:
(1)三种酸由强至弱的顺序为H2SO3>CH3COOH>H2CO3(用化学式表示).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为CO32->SO32->CH3COO->HSO3-.
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是B.
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是A.
A.c(CH3COO-)>c(HCO3-)>c(OH-) B.c(Na+)+c(H+)=c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-) D.c(CH3COO-)+c(CH3COOH)=c(HCO3-)+c(CO32-)
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为CO32->SO32->CH3COO->HSO3-.
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是B.
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是A.
A.c(CH3COO-)>c(HCO3-)>c(OH-) B.c(Na+)+c(H+)=c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-) D.c(CH3COO-)+c(CH3COOH)=c(HCO3-)+c(CO32-)
11.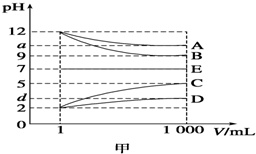 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
(1)根据pH的变化关系,写出物质的化学式:BNaOH,CHCl.
(2)写出A与C反应的离子方程式:NH3•H2O+H+═NH4++H2O.
 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
(2)写出A与C反应的离子方程式:NH3•H2O+H+═NH4++H2O.
8.常温下,部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
9.下列各组离子反应可用H++OH-=H2O表示的是( )
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Fe(OH)3与HCl | D. | HNO3与KOH |