题目内容
8.常温下,部分弱酸的电离平衡常数如下表:| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
分析 弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:酸的电离平衡常数CH3COOH>H2CO3>HCN>HCO3-,酸性:CH3COOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->CH3COO-,
A.等pH、等体积的HCOOH和HCN,n(HCN)>n(CH3COOH),则CH3COOH消耗的氢氧化钠少,所以中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者,故A错误;
B.强酸能够制取弱酸,所以二者反应生成醋酸钠和二氧化碳、水,离子方程式为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,故B正确;
C.由于酸性:CH3COOH>HCN>HCO3-,所以HCO3-与CN-、CH3COO-不反应,即Na+、CN-、CH3COO-、HCO3-等离子能大量共存,故C正确;
D.已知酸性CH3COOH>HCN,酸性越强,其盐的水解程度越小,其盐溶液的pH越小,所以等浓度的CH3COONa和NaCN溶液pH前者小于后者,故D正确;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与酸性强弱、酸根离子的水解程度的关系是解本题关系,再结合强酸制取弱酸、酸碱中和反应来分析解答题目难度中等.

练习册系列答案
相关题目
6.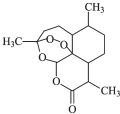 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素含有“-O-O-”键具有较强的氧化性 | |
| C. | 青蒿素易发生加成反应和氧化反应 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
3.同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是( )
| A. | 盐酸>醋酸 | B. | 醋酸>盐酸 | C. | 盐酸=醋 | D. | 无法判断 |
13.下列说法正确的是( )
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向放热反应方向移动 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
18. 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
Ⅰ.废液组成:
Ⅱ.处理方案:
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是产生大量的CO2不利于工业生产.
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:Mn2++ClO-+CO32-=MnO2↓+Cl-+CO2↑.
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:2Co2++ClO-+2CO32-+3H2O=2Co(OH)3↓+Cl-+2CO2↑;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:Co2++Ni(OH)3=Co(OH)3↓+Ni2+.
③此步骤中必须控制好NaClO溶液的用量,其原因可能是Mn2+,Co2+沉淀完全而Ni2+不被沉淀.
步骤3:回收镍
以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:产生大量氢气.
②电解的最佳pH范围是:C (填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.
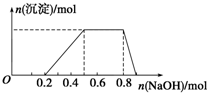 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
 CO+3H2.
CO+3H2.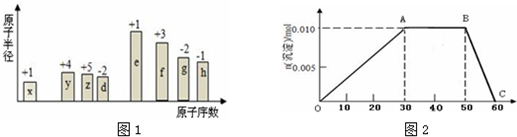
 .
.