题目内容
有A、B两种原子,A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍.A和B分别是( )
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
考点:原子核外电子排布
专题:
分析:A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍,则A元素原子有2个电子层,B元素原子有3个电子层;B原子的第二电子层电子数为8,故A元素原子L层电子数为8×
=4,故A为碳元素;A原子的第三电子层比B原子的第三电子层少3个电子,A无第三层,故B为铝元素.
| 1 |
| 2 |
解答:
解:A原子的第三电子层比B原子的第三电子层少3个电子,说明B原子的L层已经排满8个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍,则A元素原子有2个电子层,B元素原子有3个电子层;B原子的第二电子层电子数为8,故A元素原子L层电子数为8×
=4,故A为碳元素;A原子的第三电子层比B原子的第三电子层少3个电子,A无第三层,故B为铝元素.
故选D.
| 1 |
| 2 |
故选D.
点评:本题考查元素的推导,考查了核外电子排布规律、原子结构与位置关系等,难度不大,理解核外电子排布规律并能灵活运用.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
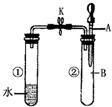 如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )| A、水与氮气 |
| B、稀硫酸与一氧化碳 |
| C、浓氢氧化钠溶液与二氧化碳 |
| D、饱和食盐水与氯气 |
下列各组离子一定能大量共存的是( )
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、CO32- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在NH4+的溶液中:SiO32-、K+、SO42-、NO3- |
| D、在HCO3-的溶液中:K+、Na+、AlO2-、NO3- |
一定温度时,反应2HI(g)?H2(g)+I2(g);△H>0 达到平衡,要使混合气体颜色加深,可采用的方法是( )
| A、减小压强 |
| B、缩小体积 |
| C、降低温度 |
| D、增大H2的浓度 |
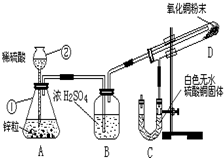 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.