题目内容
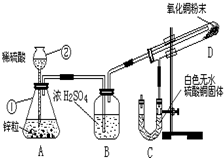 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.(1)写出编号仪器的名称:①
(2)浓H2SO4的作用是
(3)本实验需要加热的装置为
(4)在A、C、D三个装置发生的反应中属于氧化还原反应的化学方程式为:
考点:实验装置综合
专题:实验设计题
分析:(1)根据装置图分析;
(2)氢气需要进行干燥;
(3)根据反应的条件进行分析;
(4)锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化.
(2)氢气需要进行干燥;
(3)根据反应的条件进行分析;
(4)锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化.
解答:
解:(1)熟悉常见化学仪器,了解名称.图中①锥形瓶②长颈漏斗,
故答案为:锥形瓶;长颈漏斗;
(2)浓硫酸具有吸水性,可以用于干燥氢气,
故答案为:除去H2中的水蒸气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,
故答案为:D;
(4)锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化,属于氧化还原反应,锌与稀硫酸的反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;氢气与氧化铜在加热条进行反应生成铜和水,其反应的化学方程式为:H2+CuO
Cu+H2O;
故答案为:Zn+H2SO4=ZnSO4+H2↑;H2+CuO
Cu+H2O.
故答案为:锥形瓶;长颈漏斗;
(2)浓硫酸具有吸水性,可以用于干燥氢气,
故答案为:除去H2中的水蒸气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,
故答案为:D;
(4)锌与稀硫酸的反应、氢气与氧化铜的反应中均存在化合价的变化,属于氧化还原反应,锌与稀硫酸的反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;氢气与氧化铜在加热条进行反应生成铜和水,其反应的化学方程式为:H2+CuO
| ||
故答案为:Zn+H2SO4=ZnSO4+H2↑;H2+CuO
| ||
点评:本题考查了氢气的制备和性质实验,题目难度不大,学习中要注重化学实验基本操作方法.

练习册系列答案
相关题目
有A、B两种原子,A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍.A和B分别是( )
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
标准状况下22.4LH2 和C2H4的混合气体在一定条件下反应,所得气态物质完全燃烧恢复至常温后放出736KJ热量,混合气体中H2和C2H4的物质的量之比应为[已知H2、C2H4、C2H6的燃烧热(单位:KJ/mol)分别是286、1411和1560]( )
| A、1:3 | B、2:3 |
| C、3:1 | D、3:2 |
用98%的浓H2SO4(密度为1.84g/cm3)配制1mol/L的稀H2SO4 90mL,配制过程中需用仪器的先后顺序是( )
①20mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
①20mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
| A、①③⑤⑥⑦ |
| B、②③⑦⑤⑥ |
| C、②⑤⑦⑥① |
| D、④③⑦⑤⑥ |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:根据上述实验,以下说法正确的是( )


| A、气体A一定只是NO |
| B、由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液中含有K2SO3 |
| C、若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D、溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
下列四种物质的溶液,其中一种与其它三种能发生离子反应,这种物质是( )
| A、H2SO4 |
| B、KOH |
| C、BaCl2 |
| D、Na2CO3 |