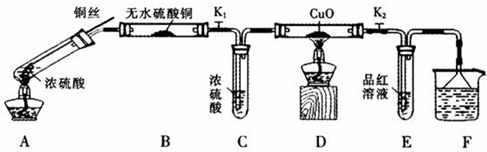
题目内容
已知25℃、101kPa时,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
(Ⅰ)写出稀硫酸与稀烧碱溶液发生反应表示中和热的热化学方程式: .
(Ⅱ)某兴趣小组用稀硫酸与稀烧碱溶液测定中和热.
(1)配制溶液:实验室配制500mL0.55mol/L的NaOH溶液时,用到的仪器有烧杯、玻璃棒、托盘天平、胶头滴管、量筒和 .
(2)中和热测定.
①实验时所需的玻璃仪器除烧杯、量筒、胶头滴管外还需 .
②实验中用50mL 0.25mol/L的稀硫酸与50mL 0.55mol/L的NaOH溶液混合反应,该小组同学采用上述试剂用量的理由是: .
③假定反应前溶液以及中和后的混合液的密度均为1.00g/cm3,三次平行操作测得数据中起始时硫酸与氢氧化钠溶液的平均温度均为16.9℃,而混合后溶液最高温度的平均值为19.6℃,比热容为 4.18J/(g?℃),则该实验中测得中和热△H= .
④上述实验结果与57.3kJ/mol有偏差,其可能原因是
A.实验装置保温隔热效果差
B.量取氢氧化钠溶液体积时仰视读数
C.所取氢氧化钠溶液分多次倒入小烧杯中
D.用温度计量取氢氧化钠溶液的温度后直接量硫酸的温度.
(Ⅰ)写出稀硫酸与稀烧碱溶液发生反应表示中和热的热化学方程式:
(Ⅱ)某兴趣小组用稀硫酸与稀烧碱溶液测定中和热.
(1)配制溶液:实验室配制500mL0.55mol/L的NaOH溶液时,用到的仪器有烧杯、玻璃棒、托盘天平、胶头滴管、量筒和
(2)中和热测定.
①实验时所需的玻璃仪器除烧杯、量筒、胶头滴管外还需
②实验中用50mL 0.25mol/L的稀硫酸与50mL 0.55mol/L的NaOH溶液混合反应,该小组同学采用上述试剂用量的理由是:
③假定反应前溶液以及中和后的混合液的密度均为1.00g/cm3,三次平行操作测得数据中起始时硫酸与氢氧化钠溶液的平均温度均为16.9℃,而混合后溶液最高温度的平均值为19.6℃,比热容为 4.18J/(g?℃),则该实验中测得中和热△H=
④上述实验结果与57.3kJ/mol有偏差,其可能原因是
A.实验装置保温隔热效果差
B.量取氢氧化钠溶液体积时仰视读数
C.所取氢氧化钠溶液分多次倒入小烧杯中
D.用温度计量取氢氧化钠溶液的温度后直接量硫酸的温度.
考点:中和热的测定
专题:
分析:(Ⅰ)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(Ⅱ)(1)根据配制一定体积一定浓度的NaOH溶液时所需的仪器来回答;
(2)①依据中和热测定实验的过程和仪器分析中和热实验时所需的玻璃仪器;
②碱过量,确保酸完全反应,热量完全放出;
③根据Q=cm△t计算放出的热量,反应热△H=-
来计算即可;
④A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
D、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度.
(Ⅱ)(1)根据配制一定体积一定浓度的NaOH溶液时所需的仪器来回答;
(2)①依据中和热测定实验的过程和仪器分析中和热实验时所需的玻璃仪器;
②碱过量,确保酸完全反应,热量完全放出;
③根据Q=cm△t计算放出的热量,反应热△H=-
| Q |
| n |
④A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
D、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度.
解答:
解:(Ⅰ)稀的强酸与强碱溶液反应的中和热为57.3kJ/mol,则稀硫酸与稀烧碱溶液中和热的热化学方程式为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(Ⅱ)(1)配制500mL0.55mol/L的NaOH溶液时,用到的仪器有烧杯、玻璃棒、托盘天平、胶头滴管、量筒和500mL容量瓶,故答案为:500mL容量瓶;
(2)①中和热测定实验时所需的玻璃仪器烧杯、量筒、胶头滴管、温度计、环形玻璃搅拌棒,故答案为:温度计、环形玻璃搅拌棒;
②碱过量,确保酸完全反应,放出的热量更准确,故答案为:使碱(NaOH)略过量,保证酸(H2SO4)充分反应;
③根据Q=cm△t=100mL×1.00g/cm3×4.18J/(g?℃)(19.6℃-16.9℃)=1128.6J,反应热△H=-
=-
=-45144J/mol=-45.144kJ/mol,故答案为:-45.144kJ/mol;
④A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;
C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;
D、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,直接测定测得温度偏低,中和热的数值偏小,故D正确;
故选ACD.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(Ⅱ)(1)配制500mL0.55mol/L的NaOH溶液时,用到的仪器有烧杯、玻璃棒、托盘天平、胶头滴管、量筒和500mL容量瓶,故答案为:500mL容量瓶;
(2)①中和热测定实验时所需的玻璃仪器烧杯、量筒、胶头滴管、温度计、环形玻璃搅拌棒,故答案为:温度计、环形玻璃搅拌棒;
②碱过量,确保酸完全反应,放出的热量更准确,故答案为:使碱(NaOH)略过量,保证酸(H2SO4)充分反应;
③根据Q=cm△t=100mL×1.00g/cm3×4.18J/(g?℃)(19.6℃-16.9℃)=1128.6J,反应热△H=-
| Q |
| n |
| 1128.6J |
| 0.05L×0.5mol/L |
④A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;
C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;
D、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,直接测定测得温度偏低,中和热的数值偏小,故D正确;
故选ACD.
点评:本题考查热反应热的测定与计算,题目难度不大,注意理解中和热的概念以及测定反应热的误差等问题.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
对某无色溶液进行酸碱性测定,测得结果呈强酸性.则下列各组离子一定不可能大量存在的是( )
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、Mg2+、Cl-、SO42- |
| C、K+、Fe3+、Cl-、SO42- |
| D、Ba2+、Al3+、Cl-、NO3- |
 如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )| A、NH3 |
| B、HCl |
| C、SO2 |
| D、NO2(假设不含N2O4) |
有A、B两种原子,A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍.A和B分别是( )
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
用98%的浓H2SO4(密度为1.84g/cm3)配制1mol/L的稀H2SO4 90mL,配制过程中需用仪器的先后顺序是( )
①20mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
①20mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
| A、①③⑤⑥⑦ |
| B、②③⑦⑤⑥ |
| C、②⑤⑦⑥① |
| D、④③⑦⑤⑥ |
下列实验装置图所示的实验操作,能达到相应的实验目的是( )
A、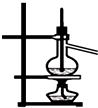 分离沸点相差较大液体混合物 |
B、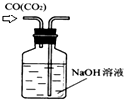 除去CO气体中的CO2气体 |
C、 向容量瓶中转移液体 |
D、 分离互不相溶的两种液体 |