题目内容
16.已知酸式盐NaHB在水溶液中存在下列反应:①NaHB=Na++HB-,②HB-≒H++B2-,③HB-+H2O≒H2B+OH-且溶液中c(H+)>c(OH-),则下列说法错误的是( )| A. | NaHB为强电解质 | B. | NaHB溶液中:c(Na+)<c(HB-)+2c(B2-) | ||
| C. | H2B为弱电解质 | D. | HB-的电离程度小于HB-的水解程度 |
分析 NaHB是盐,完全电离为强电解质,HB-即电离又水解,c(H+)>c(OH-),说明电离程度大于水解程度,电离和水解程度都很小,根据电荷守恒判断NaHB溶液中c(Na+)和c(HB-)+2c(B2-)的相对大小,H2B是弱酸,据此解答.
解答 解:A、NaHB是盐,完全电离为强电解质,故A正确;
B、NaHB溶液中:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),又c(H+)>c(OH-),所以c(Na+)<c(HB-)+2c(B2-),故B正确;
C、H2B是弱酸为弱电解质,故C正确;
D、HB-即电离又水解,c(H+)>c(OH-),说明电离程度大于水解程度,故D错误;
故选D.
点评 本题考查了弱酸的酸式盐的电离和水解,注意根据溶液的酸碱性判断电离和水解程度的大小,题目难度中等.

练习册系列答案
相关题目
6.乙烯是一种重要的化工原料通常用CH2=CH2来表示,这种表示法是( )
| A. | 电子式 | B. | 结构式 | C. | 结构简式 | D. | 最简式 |
7.下列叙述正确的是( )
| A. | S2-的结构示意图是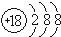 | B. | HCl 的电子式为H+[:Cl:]- | ||
| C. | H2O的结构式为H-O-H | D. | 还原性:HCl>H2S |
4.在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g)当下列物理量不再变化时,不能表明反应已达平衡的是( )
| A. | 混合气体的物质的量 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | 固体A的质量 |
11.用分液漏斗可以分离的一组液体混合物是( )
| A. | 硝基苯和水 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴和CCl4 |
5.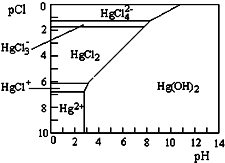 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
9. 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
回答下列问题:
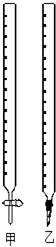
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.