题目内容
12.根据所给信息和标志,判断下列说法错误的是( )| A | B | C | D |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |  |  |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.麻黄能“止咳逆上气”,则麻黄具有治疗咳嗽的作用;
B.醋中含有乙酸,能和碳酸氢钠反应;
C.该标志为放射性物质标志;
D.该标志为循环回收标志.
解答 解:A.麻黄能“止咳逆上气”,则麻黄具有治疗咳嗽的作用,可以制作咳嗽药,故A正确;
B.醋中含有乙酸,能和碳酸氢钠反应,从而降低疗效,故B错误;
C.该标志为放射性物质标志,对环境及人有危害,所以 看到有该标志的丢弃物,应远离并报警,故C正确;
D.该标志为循环回收标志,所以贴有该标志的物品是可回收物,故D正确;
故选B.
点评 本题考查信息及标志,侧重考查学生对基本生活常识及基本标志的了解,知道化学在生产生活中的应用,会运用化学知识解决生产生活问题,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
15.下列说法正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |
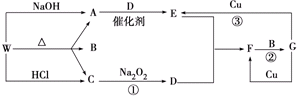
7.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3.用离子方程式解释现象Ⅰ:2Ag++SO32-=Ag2SO3↓.
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu2+和SO32-的理由是在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-.
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和Al(OH)3.
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一: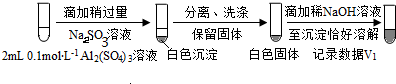
步骤二: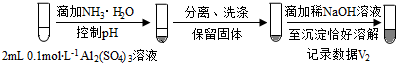 (按图形式呈现).
(按图形式呈现).
b.假设ii成立的实验证据是V1明显大于V2
(4)根据实验,亚硫酸盐的性质有溶解性、还原性、在水溶液中呈碱性.盐溶液间反应的多样性与两种盐溶液中阴、阳离子的性质和反应条件有关.
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu2+和SO32-的理由是在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-.
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和Al(OH)3.
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:

步骤二:
 (按图形式呈现).
(按图形式呈现).b.假设ii成立的实验证据是V1明显大于V2
(4)根据实验,亚硫酸盐的性质有溶解性、还原性、在水溶液中呈碱性.盐溶液间反应的多样性与两种盐溶液中阴、阳离子的性质和反应条件有关.
17.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示, 下列判断错误的是( )
下列判断错误的是( )
 下列判断错误的是( )
下列判断错误的是( )| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
4.下列说法不正确的是( )
| A. | 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量 | |
| B. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| C. | Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
1.下列有关化学用语表示正确的是( )
| A. | 中子数为10的氧原子:${\;}_8^{10}O$ | B. | Mg2+的结构示意图: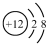 | ||
| C. | 硫化钠的电子式: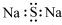 | D. | 甲酸甲酯的结构简式:C2H4O2 |
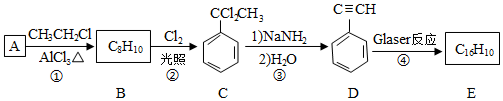
 ,D的化学名称为苯乙炔.
,D的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.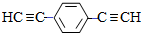 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n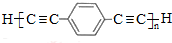 +(n-1)H2.
+(n-1)H2.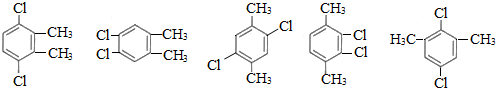 任意三种.
任意三种.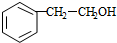 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$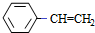 $\stackrel{Br_{2}/H_{2}O}{→}$
$\stackrel{Br_{2}/H_{2}O}{→}$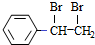 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$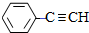 .
.