题目内容
将9克镁、铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入5mol/L的氢氧化钠中,若生成沉淀最多,加入的氢氧化钠的体积为 .
考点:化学方程式的有关计算
专题:计算题
分析:镁铝合金与盐酸反应,金属完全溶解,生成氯化镁和氯化铝,加入4mol/L的NaOH溶液,生成的沉淀最多时,Mg2+和Al3+全部转化为沉淀,所以溶液中的溶质只有NaCl,根据氯原子和钠原子守恒解题.
解答:
解:镁铝合金与盐酸反应,金属完全溶解,发生的反应为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl,Mg2+和Al3+全部转化为沉淀,所以溶液中的溶质只有NaCl,
根据氯原子和钠原子守恒,可得n(NaOH)=n(NaCl)=n(HCl)=2mol/L×0.5L=1mol,故需要氢氧化钠溶液体积=
=0.2L=200mL,
答:生成沉淀最多,加入的氢氧化钠的体积为200mL.
分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl,Mg2+和Al3+全部转化为沉淀,所以溶液中的溶质只有NaCl,
根据氯原子和钠原子守恒,可得n(NaOH)=n(NaCl)=n(HCl)=2mol/L×0.5L=1mol,故需要氢氧化钠溶液体积=
| 1mol |
| 5mol/L |
答:生成沉淀最多,加入的氢氧化钠的体积为200mL.
点评:本题考查混合物计算,难度中等,注意Mg2+和Al3+全部转化为沉淀时,NaOH不能过量,即氢氧化铝不能溶解,溶液中的溶质只有NaCl,注意利用原子守恒解题.

练习册系列答案
相关题目
同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体,则两容器内的气体一定具有相同的( )
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
| A、①② | B、②③⑤ |
| C、②③⑥ | D、①②⑥ |
下列反应的离子方程式书写正确的是( )
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
| C、NaHCO3溶液和过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+2H2O+CO32- |
| D、NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O═2Al(OH)3↓+CO32- |
下列有关物质保存的说法不正确的是( )
| A、钠保存在煤油中 |
| B、氯水可长期保存在无色瓶中 |
| C、过氧化钠应密封保存 |
| D、漂白粉不应敞开在空气中 |


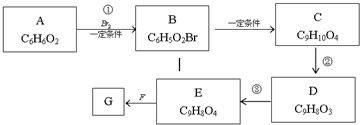
 DEET在一定条件下,可通过下面的路线来合成:
DEET在一定条件下,可通过下面的路线来合成: