题目内容
16.实验是化学研究的基础.下列对实验现象的描述错误的是( )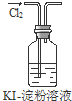 | 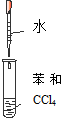 | 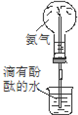 | 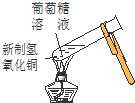 |
| ① | ② | ③ | ④ |
| A. | 实验①中溶液出现蓝色 | |
| B. | 实验②试管出现分层现象,上下为油层,中间为水层 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现砖红色沉淀 |
分析 A.氯气与KI反应生成碘单质,淀粉遇碘变蓝;
B.水的密度比四氯化碳的密度小;
C.氨气极易溶于水,溶液显碱性;
D.氢氧化铜能氧化葡萄糖.
解答 解:A.氯气与KI反应生成碘单质,淀粉遇碘变蓝,则①中溶液出现蓝色,故A正确;
B.水的密度比四氯化碳的密度小,则②试管出现分层现象,下层为油层,上层为水层,故B错误;
C.氨气极易溶于水,溶液显碱性,则③中烧瓶内溶液变红色,故C正确;
D.氢氧化铜能氧化葡萄糖,氢氧化铜被还原生成氧化亚铜,则④中出现砖红色沉淀,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列物质分类合理的是( )
| A. | 氧化物:CO | B. | 酸:NaHSO4 | C. | 碱:纯碱 | D. | 铵盐:NH3•H2O |
7.下列离子方程式书写正确的是( )
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2 | |
| C. | 氯化铝与过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 硫酸氢钠与氢氧化钡1:1反应:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
4.取一小块金属钠放在燃烧匙中加热,下列实验现象描述正确的是( )
①金属钠先熔化 ②在空气中燃烧,产生黄色火焰 ③燃烧后得白色固体 ④燃烧后生成淡黄色固体物质.
①金属钠先熔化 ②在空气中燃烧,产生黄色火焰 ③燃烧后得白色固体 ④燃烧后生成淡黄色固体物质.
| A. | ①②④ | B. | ①②③ | C. | ①② | D. | ①②③④ |
11.下列说法中,不正确的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、葡萄糖都是无色溶于水的有机化合物 |
1.今年以来,我国“高铁出口”成为新闻高频词,高铁产业的发展也给铝工业带来了春天.最近,美国密歇根州立大学国立超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是( )
| A. | 属于金属元素 | B. | 中子数与质子数之差为29 | ||
| C. | 原子的核外电子数为13 | D. | 27Al和42Al是两种不同的核素 |
8.下列说法正确的组合是( )
①二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸
②强电解质都易溶于水
③体积为2L,物质的量浓度为0.5mol•L-1的氢氟酸中含1mol氟离子
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液能导电的原因是由于溶液中有自由移动的离子.
①二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸
②强电解质都易溶于水
③体积为2L,物质的量浓度为0.5mol•L-1的氢氟酸中含1mol氟离子
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液能导电的原因是由于溶液中有自由移动的离子.
| A. | ①③⑤ | B. | ②④⑤ | C. | 只有⑤ | D. | 只有② |
5.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 2L1mol/LNaF溶液中含Na+和F-之和为4NA | |
| B. | 在常温常压下,22gCO2含有的共用电子对数为2NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 11mol甲基(-CH3)中所含电子数为10NA |
6.下列说法错误的是( )
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |