题目内容
1.今年以来,我国“高铁出口”成为新闻高频词,高铁产业的发展也给铝工业带来了春天.最近,美国密歇根州立大学国立超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是( )| A. | 属于金属元素 | B. | 中子数与质子数之差为29 | ||
| C. | 原子的核外电子数为13 | D. | 27Al和42Al是两种不同的核素 |
分析 先根据Al的电子排布判断元素在周期表中的位置;判断A根据质子数、中子数、质量数之间的关系,判断B根据原子的质子数与电子数的关系,判断C根据同位素的定义判断D.
解答 解析:Al元素为13号元素,根据构造原理,核外电子排布式1S22S22P63S23P1,字母前的数字表示电子层数,所以Al属第三周期第ⅢA族.
A.铝是金属元素,故A正确;
B.质子数+中子数=质量数,中子数与质子数之差=(质量数-质子数)-质子数=(42-13)-13=16,故B错误;
C.原子的核外电子数等于核内质子数,所以核外有13个电子,故C正确;
D.27Al和42Al是质子数相同中子数不同的同一元素,所以是不同的两种核素,故D正确.
故选B.
点评 本题考查的是有关质子数、中子数、电子数之间的计算,以及同位素的定义,是小型综合题,侧重于基础知识的考查.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
11.下列关于食品添加剂的叙述不正确的是( )
| A. | 醋可以作为防腐剂和调味剂 | B. | 味精可作调味剂 | ||
| C. | 甲醛是一种很好的食品防腐剂 | D. | 苯甲酸钠可用作食品添加剂 |
12.下列关于原子结构模型的演变顺序,按照先后顺序排列正确的是( )
①卢瑟福的“带核原子模型”
②汤姆生的“葡萄干面包式”
③道尔顿的原子学说
④玻尔的原子结构模型(轨道理论)
①卢瑟福的“带核原子模型”
②汤姆生的“葡萄干面包式”
③道尔顿的原子学说
④玻尔的原子结构模型(轨道理论)
| A. | ①③②④ | B. | ③②①④ | C. | ③①②④ | D. | ④③②① |
9.描述 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )
 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 与苯环直接相连的原子都在同一平面上 | |
| B. | 分子中共有10个不饱和碳原子 | |
| C. | 最多有18个原子可能处在同一个平面上 | |
| D. | 分子式为C11H6ClF3 |
6.聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类:主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示).
(1)一定条件下,向1.0mol/LAlCl3溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如表:
①在一定温度下,AlT越大,pH越小(填“越大”、“越小”或“不变”).
②如将AlT=2.520mol•L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+.
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1.当T>80℃时,AlT显著下降的原因是温度升高,水解程度加大,产生氢氧化铝沉淀.
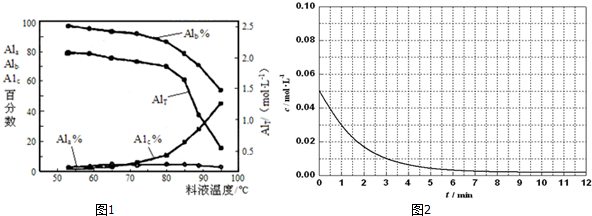
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJ•mol-1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(a+b)kJ•mol-1(用含a、b的代数式表示).反应①常压下在1900℃的高温下才能进行,说明△H>0(填“>”“=”或“<”).
(4)物质中的铝元素可以通过将铝元素转化成Al3+,然后在水溶液中用铝试剂(NH4)3C19H11O3(COO)3(商品名为“阿罗明拿)测定,在弱酸性溶液中,Al3+可以用铝试剂反应,生成玫瑰红色的物质.随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是C.
A.pH计 B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(5)已知Al3++4X?2[(Al${\;}_{\frac{1}{2}}$X2)1.5+],X表示显色剂,Al${\;}_{\frac{1}{2}}$X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出Al${\;}_{\frac{1}{2}}$X21.5+浓度随时间的变化曲线.
(1)一定条件下,向1.0mol/LAlCl3溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如表:
| AlT/(mol•L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
②如将AlT=2.520mol•L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+.
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1.当T>80℃时,AlT显著下降的原因是温度升高,水解程度加大,产生氢氧化铝沉淀.

(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJ•mol-1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(a+b)kJ•mol-1(用含a、b的代数式表示).反应①常压下在1900℃的高温下才能进行,说明△H>0(填“>”“=”或“<”).
(4)物质中的铝元素可以通过将铝元素转化成Al3+,然后在水溶液中用铝试剂(NH4)3C19H11O3(COO)3(商品名为“阿罗明拿)测定,在弱酸性溶液中,Al3+可以用铝试剂反应,生成玫瑰红色的物质.随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是C.
A.pH计 B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(5)已知Al3++4X?2[(Al${\;}_{\frac{1}{2}}$X2)1.5+],X表示显色剂,Al${\;}_{\frac{1}{2}}$X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出Al${\;}_{\frac{1}{2}}$X21.5+浓度随时间的变化曲线.
13.下列离子方程式正确的是( )
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
11.下列说法正确的是( )
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |



