题目内容
8.下列说法正确的组合是( )①二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸
②强电解质都易溶于水
③体积为2L,物质的量浓度为0.5mol•L-1的氢氟酸中含1mol氟离子
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液能导电的原因是由于溶液中有自由移动的离子.
| A. | ①③⑤ | B. | ②④⑤ | C. | 只有⑤ | D. | 只有② |
分析 ①二氧化硅不溶于水;
②难溶于水的某些盐属于强电解质;
③氟化氢是弱酸,溶液中存在电离平衡;
④H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关;
⑤溶液导电的原因是溶液中有自由移动的阴阳离子;
解答 解:①二氧化硅和二氧化碳都是酸性氧化物,二氧化碳能和水反应生成碳酸,但二氧化硅不溶于水,和水不反应,故①错误;
②电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故②错误;
③体积为2L,物质的量浓度为0.5mol•L-1的氢氟酸中,氟化氢是弱酸,溶液中存在电离平衡,含氟离子小于1mol,故③错误;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;
故选C.
点评 本题主要考查的是强弱电解质的概念以及判断,涉及溶液导电的原因、溶液中离子浓度大小比较等,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若减小压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L•min) | |
| D. | 当反应吸收热量为0.5QkJ时,生成的HCl通入1L 1mol/L的NaOH溶液恰好完全反应 |
19.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
3.下列有关化学用语表示不正确的是( )
| A. | 硝基苯的结构简式: | B. | 氯化铵的电子式: | ||
| C. | 甲烷的球棍模型: | D. | 乙醇的结构简式:CH3CH2OH |
13.下列离子方程式正确的是( )
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
20.下列各组中的离子,能再溶液中大量共存的是( )
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
17.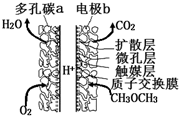 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
18.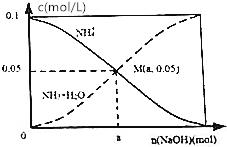 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |