题目内容
已知元素的电负性和原子半径、化合价等一样,也是元素的一种基本性质,表Z-1给出14种元素的电负性:
表Z-1
试结合元素周期律知识完成下列填空:
(1)根据上表给出的数据可推知元素的电负性具有的变化规律是 ;
(2)根据你的理解,元素的电负性是指 ;
(3)预测K与Na、Br与I元素的电负性关系:K Na,Br I.(填“>”或“<”)
表Z-1
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)根据上表给出的数据可推知元素的电负性具有的变化规律是
(2)根据你的理解,元素的电负性是指
(3)预测K与Na、Br与I元素的电负性关系:K
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:(1)从同周期元素自左到右排列,然后结合数据分析;
(2)同一周期自左到右非金属性逐渐增强,电负性逐渐增大,表现元素的原子在化合物中把电子吸引向自己的本领;
(3)同主族自上而下,电负性逐渐减小.
(2)同一周期自左到右非金属性逐渐增强,电负性逐渐增大,表现元素的原子在化合物中把电子吸引向自己的本领;
(3)同主族自上而下,电负性逐渐减小.
解答:
解:(1)由表中数据可知,第二周期元素从Li~F,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从Na~S,随着原子序数的递增,元素的电负性也逐渐增大,并呈周期性变化,
故答案为:在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;
(2)同一周期自左到右非金属性逐渐增强,电负性逐渐增大,表现元素的原子在化合物中把电子吸引向自己的本领,
故答案为:元素的原子在化合物中把电子吸引向自己的本领;
(3)同主族自上而下,电负性逐渐减小,因此电负性:K<Na,Br>I,
故答案为:<;>.
故答案为:在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;
(2)同一周期自左到右非金属性逐渐增强,电负性逐渐增大,表现元素的原子在化合物中把电子吸引向自己的本领,
故答案为:元素的原子在化合物中把电子吸引向自己的本领;
(3)同主族自上而下,电负性逐渐减小,因此电负性:K<Na,Br>I,
故答案为:<;>.
点评:本题考查了电负性的含义和应用,难度不大,一般情况下电负性的变化规律与元素非金属性的变化规律一致.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
某烷烃分子中有124个氢原子,则该烃所含的碳原子数目为( )
| A、60 | B、61 | C、62 | D、63 |
用固体配制100毫升一定物质的量浓度的溶液时,必须用到的仪器是( )
A、 分液漏斗 |
B、 圆底烧瓶 |
C、 容量瓶 |
D、 集气瓶 |
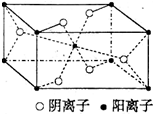 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.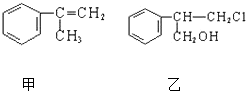 由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):