题目内容
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
请回答下列问题:
(1)五种元素中原子半径最大的是(写元素符号) .
(2)写出X、Z、Q形成的化合物的电子式 .
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
B(在水溶液中进行),其中C是溶于水显酸性的气体,
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,由B转化为A的离子方程式为 .
②如果A、B、D均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 .
请回答下列问题:
(1)五种元素中原子半径最大的是(写元素符号)
(2)写出X、Z、Q形成的化合物的电子式
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
| C |
| D |
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,由B转化为A的离子方程式为
②如果A、B、D均由三种元素组成,B为两性不溶物,则A的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族H元素、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;
(2)H、O、Na形成的化合物为NaOH,由钠离子与氢氧根离子构成;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,则A为Na2CO3、D为NaOH,B为NaHCO3;
②如果A、B、D均由三种元素组成,B为两性不溶物,则B为Al(OH)3,D为NaOH,A为NaAlO2.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;
(2)H、O、Na形成的化合物为NaOH,由钠离子与氢氧根离子构成;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,则A为Na2CO3、D为NaOH,B为NaHCO3;
②如果A、B、D均由三种元素组成,B为两性不溶物,则B为Al(OH)3,D为NaOH,A为NaAlO2.
解答:
解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族H元素、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Al>C>O>H,
故答案为:Na;
(2)H、O、Na形成的化合物为NaOH,由钠离子与氢氧根离子构成,其电子式为: ,
,
故答案为: ;
;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,则A为Na2CO3、D为NaOH,B为NaHCO3,由B转化为A的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
②如果A、B、D均由三种元素组成,B为两性不溶物,则B为Al(OH)3,D为NaOH,A为NaAlO2,由A转化为B的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Al>C>O>H,
故答案为:Na;
(2)H、O、Na形成的化合物为NaOH,由钠离子与氢氧根离子构成,其电子式为:
 ,
,故答案为:
 ;
;(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,
①如果A、D均由三种元素组成且A、B、D溶液呈碱性,则A为Na2CO3、D为NaOH,B为NaHCO3,由B转化为A的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
②如果A、B、D均由三种元素组成,B为两性不溶物,则B为Al(OH)3,D为NaOH,A为NaAlO2,由A转化为B的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-.
点评:本题考查元素化合物推断,推断元素是解题的关键,需要学生熟练掌握元素化合物性质,(3)题中②离子方程式书写为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某致基因突变物质的结构简式如图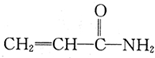 .下列相关分析正确的是( )
.下列相关分析正确的是( )
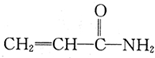 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为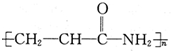 |
下列实验能达到目的是( )
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |
下列物质会造成“白色污染”的是( )
| A、白纸 | B、石灰 |
| C、废弃塑料 | D、蛋白质 |
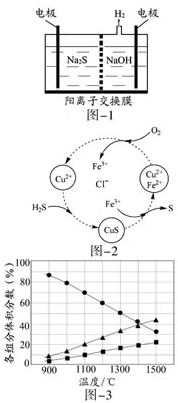 硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.