题目内容
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气.以下物质可作洗涤剂的是 (选填序号).
a.Ca(OH)2 b.CaCl2c.Na2CO3 d.NaHSO3
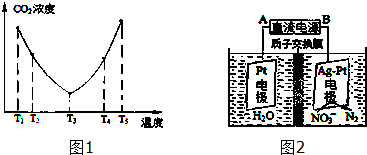
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq)△H3,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1
则:
①△H3 0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: .
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则反应离子方程式为: .
②电化学降解NO3-的原理如图2,阴极反应式为: .
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气.以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq)△H3,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1

则:
①△H3
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则反应离子方程式为:
②电化学降解NO3-的原理如图2,阴极反应式为:
考点:探究温度、压强对化学反应速率的影响,电解原理,二氧化硫的化学性质
专题:
分析:(1)工业生产中选择尾气吸收剂,主要看能否反应;
(2)①从c(CO2)的变化趋势可见,开始时变小是没达到平衡,拐点是平衡点,其后,随温度的升高c(CO2)增大,说明平衡向逆向移动,反应放热;
②该反应是放热反应,温度升高,平衡逆向移动,c(CO2)自然升高;
(3)①用H2将NO3-还原为N2且溶液的碱性明显增强,说明氢反应后生成了OH-,氮元素生成N2,依据得失电子守恒、原子守恒和电荷守恒可写出该离子方程式;
②与电源正极相连的是阳极,发生氧化反应,从图上可见,在与B相连的电极上NO3-生成了N2,发生还原反应,可见A为阳极;在阴极上NO3-生成了N2,且有质子交换膜,可见有H+在阳极参与反应,依据依据原子守恒和电荷守恒可写出电极反应式.
(2)①从c(CO2)的变化趋势可见,开始时变小是没达到平衡,拐点是平衡点,其后,随温度的升高c(CO2)增大,说明平衡向逆向移动,反应放热;
②该反应是放热反应,温度升高,平衡逆向移动,c(CO2)自然升高;
(3)①用H2将NO3-还原为N2且溶液的碱性明显增强,说明氢反应后生成了OH-,氮元素生成N2,依据得失电子守恒、原子守恒和电荷守恒可写出该离子方程式;
②与电源正极相连的是阳极,发生氧化反应,从图上可见,在与B相连的电极上NO3-生成了N2,发生还原反应,可见A为阳极;在阴极上NO3-生成了N2,且有质子交换膜,可见有H+在阳极参与反应,依据依据原子守恒和电荷守恒可写出电极反应式.
解答:
解:(1)在题给的四种物质中,CaCl2和NaHSO3不能与SO2反应,Ca(OH)2 和Na2CO3 可以反应,
故答案为:ac;
(2)①从c(CO2)的变化趋势可见,开始时变小是没达到平衡,反应向正向进行,拐点是平衡点,其后,随温度的升高c(CO2)增大,说明平衡向逆向移动,故△H<0,
故答案为:<;
②拐点是平衡点,切△H<0,T3后,随温度的升高平衡向逆向移动,c(CO2)增大,
故答案为:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解);
(3)①NO3-还原为N2且溶液的碱性明显增强,说明H2反应后生成了OH-.依据电荷守恒NO3-与OH-的化学计量数应相同;因为生成N2,NO3-的化学计量数一定是2或2的倍数,且2molNO3-反应转移10mol电子,据得失电子守恒,需H25mol 可得:2NO3-+5H2→N2+2OH-
根据原子守恒,还应生成4mol4H2O,
故答案为:2NO3-+5H2=N2+2OH-+4H2O;
②图上可见,在与B相连的电极上NO3-生成了N2,发生还原反应,是阴极,可见A为阳极;在阴极上NO3-生成了N2,阳极上只能是OH-反应生成O2,可见有H+在阳极参与反应,2molNO3-反应10mol电子生成1molN2,2 NO3-+10e-→N2,12molH+恰好结合O生成H2O,并且也符合电荷守恒,
故答案为:2NO3-+12 H++10e-=N2↑+6H2O.
故答案为:ac;
(2)①从c(CO2)的变化趋势可见,开始时变小是没达到平衡,反应向正向进行,拐点是平衡点,其后,随温度的升高c(CO2)增大,说明平衡向逆向移动,故△H<0,
故答案为:<;
②拐点是平衡点,切△H<0,T3后,随温度的升高平衡向逆向移动,c(CO2)增大,
故答案为:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解);
(3)①NO3-还原为N2且溶液的碱性明显增强,说明H2反应后生成了OH-.依据电荷守恒NO3-与OH-的化学计量数应相同;因为生成N2,NO3-的化学计量数一定是2或2的倍数,且2molNO3-反应转移10mol电子,据得失电子守恒,需H25mol 可得:2NO3-+5H2→N2+2OH-
根据原子守恒,还应生成4mol4H2O,
故答案为:2NO3-+5H2=N2+2OH-+4H2O;
②图上可见,在与B相连的电极上NO3-生成了N2,发生还原反应,是阴极,可见A为阳极;在阴极上NO3-生成了N2,阳极上只能是OH-反应生成O2,可见有H+在阳极参与反应,2molNO3-反应10mol电子生成1molN2,2 NO3-+10e-→N2,12molH+恰好结合O生成H2O,并且也符合电荷守恒,
故答案为:2NO3-+12 H++10e-=N2↑+6H2O.
点评:本题考查知识点较多,有一定难度,特别是第(3)问,出的很好.符合现在的高考要求,起点相同,跨度较大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶 液; ③加入稍过量的BaCl2溶液;④滴入适量的稀盐酸;⑤过滤.正确的操作顺序是( )
| A、②③①⑤④ |
| B、①②③⑤④ |
| C、②③①④⑤ |
| D、③⑤②①④ |
下表中物质的分类组合完全正确的是( )
| 选项 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | HF | CaCO3 | HClO | CH3COONH4 |
| 非电解质 | SO2 | 金属Al | H2O | C2H5OH |
| A、A | B、B | C、C | D、D |
已知在一定条件下能发生下列反应:N2+3Mg
Mg3N2(固),空气缓缓通过下图装置时,依次除去的气体是( )

| ||

| A、CO2、H2O、O2、N2 |
| B、N2、O2、CO2、H2O |
| C、H2O、CO2、N2、O2 |
| D、CO2、N2、H2O、O2 |
能用酒精灯直接加热的一组仪器是( )
| A、蒸馏烧瓶、漏斗 |
| B、容量瓶、冷凝管 |
| C、坩埚、试管 |
| D、分液漏斗、烧杯 |