题目内容
19.天津港“8•12”危化仓库爆炸,造成生命、财产重大损失,其爆炸品中有金属钠.运输金属钠的集装箱应贴有的警示标识是( )| A. |  氧化剂 | B. |  爆炸品 | C. |  剧毒品 | D. |  遇湿易燃物品 |
分析 钠性质活泼,易与水、氧气反应,与水反应生成氢气,易燃、易爆,以此解答该题.
解答 解:钠性质活泼,为强还原剂,易与水、氧气反应,与水反应生成氢气,易燃、易爆,属于遇湿易燃物品.
故选D.
点评 本题考查钠的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
20.X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示,已知X、Y、Z的质子数之和为31.试回答:
(1)它们的元素符号是C;Mg;Al.
(2)X的最高价氧化物的化学式为CO2,X元素的最简单气态氢化物的分子式为CH4.
(3)Z的最高价氧化物是两性(选填“两性”“酸性”或“碱性”)氧化物.
(4)Y与水反应的化学方程式2Mg+2H2O═Mg(OH)2+H2↑.
| X | ||
| Y | Z |
(2)X的最高价氧化物的化学式为CO2,X元素的最简单气态氢化物的分子式为CH4.
(3)Z的最高价氧化物是两性(选填“两性”“酸性”或“碱性”)氧化物.
(4)Y与水反应的化学方程式2Mg+2H2O═Mg(OH)2+H2↑.
1.甲烷和乙醇均属于( )
| A. | 酸 | B. | 碱 | C. | 氧化物 | D. | 有机物 |
4.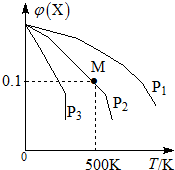 某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
 某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | |
| B. | 压强大小有P3>P2>P1 | |
| C. | 平衡后加入高效催化剂使气体相对分子质量增大 | |
| D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
11.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
| A. | 铜和浓硝酸反应 | B. | 氧化铜和硝酸反应 | ||
| C. | 铜和稀硝酸反应 | D. | 氯化铜和硝酸银反应 |
8.取a g某物质在氧气中完全燃烧,将其全部产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g.下列物质中能满足上述结果的是( )
①H2
②CO
③CH4
④C6H12O6
⑤HCOOH
⑥C12H22O11.
①H2
②CO
③CH4
④C6H12O6
⑤HCOOH
⑥C12H22O11.
| A. | ③⑥ | B. | 只有①② | C. | ①②④ | D. | 只有 ⑤ |
9.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
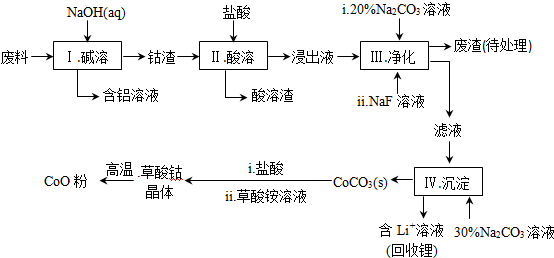
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成氯气的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的成分有LiF、Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)某锂离子电池的总反应为C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成氯气的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的成分有LiF、Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)某锂离子电池的总反应为C+LiCoO2
 LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.