题目内容
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1L 0.1mol/L的NaOH溶液中氧原子个数为0.1NA | |
| B. | 3g SiO2中Si-O数目为0.1NA | |
| C. | 0.1 mol钠与足量O2充分反应时,转移的电子数为0.1NA | |
| D. | 0.2 mol SO2与0.1mol O2充分反应,产物的分子数为0.1NA |
分析 A.氢氧化钠溶液中,氢氧化钠和水都含有氧原子;
B.1molSiO2晶体存在4molSi-O键;
C.钠与氧气反应生成+1价钠离子;
D.二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底.
解答 解:A.氢氧化钠溶液中,氢氧化钠和水都含有氧原子,所以1L 0.1mol/L的NaOH溶液中氧原子个数远远大于0.1NA,故A错误;
B.3g SiO2物质的量为$\frac{3g}{60g/mol}$=0.05mol,含有Si-O物质的量为0.05mol×4=0.2mol,即0.2NA,故B错误;
C.0.1 mol钠与足量O2充分反应时,生成0.1mol钠离子,转移的电子数为0.1NA,故C正确;
D.0.2 mol SO2与0.1mol O2充分反应,生成的三氧化硫物质的量小于0.1mol,产物的分子数小于0.1NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,熟练掌握公式的使用和物质的结构是解题关键,注意可逆反应不能进行到底特点,题目难度不大.

练习册系列答案
相关题目
8.取a g某物质在氧气中完全燃烧,将其全部产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g.下列物质中能满足上述结果的是( )
①H2
②CO
③CH4
④C6H12O6
⑤HCOOH
⑥C12H22O11.
①H2
②CO
③CH4
④C6H12O6
⑤HCOOH
⑥C12H22O11.
| A. | ③⑥ | B. | 只有①② | C. | ①②④ | D. | 只有 ⑤ |
5.与化学相关的知识散见于中国传统文化典籍之中.下列有关说法不正确的是( )
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| B. | 某古剑“以剂钢为刃,铁为茎干,…,”“剂钢”指的是铁的合金 | |
| C. | 《梦溪笔谈》载:“高奴县出脂水,燃之如麻,但烟甚浓”,所述“脂水”属于石油 | |
| D. | 《肘后备急方》载:“青蒿一握,以水二升渍,绞取汁”,如此提取青蒿素纯属萃取 |
12.在100ml硝酸和硫酸的混合液中,两种酸的物质的量浓度之和是0.6mol/l.向混合液中加入足量的铜粉,加热充分反应,所得溶液中铜离子的物质的量浓度最大值为(忽略反应前后溶液体积变化)( )
| A. | 0.30mol/l | B. | 0.225mol/l | C. | 0.45mol/l | D. | 0.36mol/l |
2.废铅蓄电池的一种回收利用工艺流程如图所示: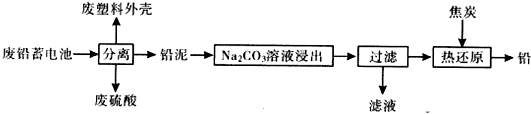
部分难溶电解质的性质如表:
回答下列问题:
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Ksp(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
9.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
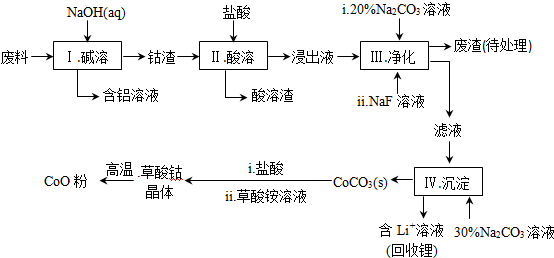
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成氯气的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的成分有LiF、Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)某锂离子电池的总反应为C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成氯气的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的成分有LiF、Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)某锂离子电池的总反应为C+LiCoO2
 LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
6.有关实验的说法中正确的是( )
| A. | 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 | |
| B. | 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 | |
| C. | 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
7.在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 | |
| B. | v正(CO2)=v逆(H2O) | |
| C. | 容器内混合气体密度保持不变 | |
| D. | 3molH-H键断裂同时断裂3molH-O键 |