题目内容
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、标准状态下,22.4L水中含有的氧原子数为NA |
| B、常温常压下,8gO2含有4 NA个电子 |
| C、25℃时,pH=13的1L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、53.5gNH4Cl中含有H-Cl键的个数为4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.气体摩尔体积适用于气体;
B.计算8g氧气的质量,1molO2中含有16mol电子;
C.根据c(H+)×c(OH-)=10-14解题;
D.氯化铵中不存在H-Cl键.
B.计算8g氧气的质量,1molO2中含有16mol电子;
C.根据c(H+)×c(OH-)=10-14解题;
D.氯化铵中不存在H-Cl键.
解答:
解:A.标准状态下,水为液体,不适用气体摩尔体积,故A错误;
B.1molO2中含有16mol电子,8g氧气的质量为:
=0.25mol,含电子数0.25mol×16×NA=4 NA,故B正确;
C.pH=-lgC(H+),25°C时,c(H+)×c(OH-)=10-14,pH=13,c(H+)=10-13 根据c(H+)×c(OH-)=10-14,所以c(OH-)=0.1mol/L,所以n(OH-)=0.1×1.0=0.1mol,所以为0.1NA,故C错误;
D.氯化铵中不存在H-Cl键,故D错误;
故选:B.
B.1molO2中含有16mol电子,8g氧气的质量为:
| 8g |
| 32g/mol |
C.pH=-lgC(H+),25°C时,c(H+)×c(OH-)=10-14,pH=13,c(H+)=10-13 根据c(H+)×c(OH-)=10-14,所以c(OH-)=0.1mol/L,所以n(OH-)=0.1×1.0=0.1mol,所以为0.1NA,故C错误;
D.氯化铵中不存在H-Cl键,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗常数,注意标况下的物质状态,注意氯化铵中化学键的类型,本题难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
如图是回收利用H2S的工艺流程.下列说法不正确的是( )

| A、反应①的离子方程式:2Fe3++H2S═2Fe2++S↓+2H+ | ||||
| B、反应②中的阴极反应式为:2H++2e-═H2↑ | ||||
C、该流程的总反应式为:H2S
| ||||
| D、该过程中,能量转化形式有两种 |
 如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是( )
如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是( )| A、三种元素中,Z元素原子半径最小 |
| B、X、Y 两种元素的气态氢化物能相互反应 |
| C、Z位于元素周期表中第2周期、第ⅥA族 |
| D、Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应 |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、硫酸、纯碱、CaSO4 |
| B、HCl、烧碱、CuSO4 |
| C、HNO3、乙醇、氯化钠 |
| D、碳酸、CaO、苛性钠 |
煤化工的产品很多,如合成气(CO、H2)、甲醇等对煤炭工业转型具有重要意义.下列说法不正确的是( )
| A、煤转化为气态燃料,可以降低碳的排放 |
| B、甲醇的沸点是64.5℃,甲醇中的水分可采用蒸馏法分离 |
| C、工业上利用饱和的K2CO3溶液分离回收废气中的CO2,符合低碳经济理念 |
| D、采用内衬聚四氟乙烯的钢管输送合成气,可有效减缓钢管的腐蚀 |
下列各组离子在水溶液中能大量共存,但用盐酸酸化后,不能大量共存的是( )
| A、Fe3+、K+、NO3-、SO42- |
| B、Al3+、Na+、HCO3-、SO42- |
| C、NO3-、K+、Al(OH)4-、HSO3- |
| D、Na+、K+、S2O32-、Cl- |
科学家已经合成出氧的一种单质O4,下列关于该物质的说法正确的是( )
| A、摩尔质量是64g |
| B、是氧的一种同位素 |
| C、分子中含有离子键 |
| D、是氧的一种同素异形体 |
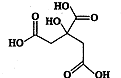 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
 2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.
2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.