题目内容
2.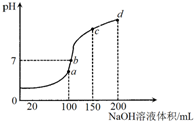 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
分析 A、a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性;
B、b点溶液为中性,结合电荷守恒可知:c(Na+)+c(NH4+)=2c(SO42-);
C.c点氢氧化钠的体积为150ml,所以3n(N)=2n(Na);
D、根据电荷守恒d点c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-).
解答 解:A、a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,所以a点水的电离程度最大,故A正确;
B、b点溶液为中性,结合电荷守恒可知:c(Na+)+c(NH4+)=2c(SO42-),故B错误;
C.c点氢氧化钠的体积为150ml,所以3n(N)=2n(Na),则是3c(NH4+)+3c(NH3•H2O)=2c(Na+),故C错误;
D、根据电荷守恒d点c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象各点发生反应及对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
12.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓硫酸,Kw不变 | |
| B. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| D. | 将pH=1的强酸溶液加水稀释后,溶液中各离子的浓度均减小 |
13.关于硅及其化合物用途的叙述中,正确的有( )
| A. | Na2SiO3可用作助燃剂 | B. | SiO2可用作制造光导纤维 | ||
| C. | 单晶硅可用于制造太阳能电池 | D. | Si可用作制造变压器铁芯的原料 |
10.下列说法中正确的是( )
| A. | P4和CH4分子的立体构型都是正四面体形且键角都为109°28' | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| C. | 单质的晶体中一定不存在阴离子 | |
| D. | SO2、BF3、NC13分子中所有原子的最外层电子均未达到8电子稳定结构 |
17.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| B. | 歼-20飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 将地沟油制成肥皂,可以提高资源的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
7.有机物Z常存在于化妆品中,起到美白功效.X、Y、Z的转化关系如图:
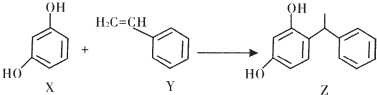
若NA为阿伏加德罗常数的值,则下列叙述正确的是( )

若NA为阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | l mol X中位于同一平面的原子数目最多为14NA | |
| B. | 0.5 molY最多可与44.8 L H2发生加成反应 | |
| C. | l moI Y完全燃烧消耗氧气的分子数为8NA | |
| D. | 1 mol Z中碳碳双键的数目为6NA |
14.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
11.槲皮素是苹果多酚中的一种.下列叙述正确的是( )
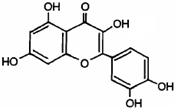

| A. | 在浓硫酸加热下,槲皮素可发生消去反应 | |
| B. | 槲皮素分子中不含手性碳原子 | |
| C. | 槲皮素的苯溶液加入浓溴水产生白色沉淀 | |
| D. | 1mol槲皮素最多可与5molNaOH发生中和反应 |
12.2015年10月5日,诺贝尔奖官方推特消息,中国女药学家屠呦呦因创制新型抗疟药---青蒿素和双氢青蒿素 的贡献而获得诺贝尔生理学或医学奖.青蒿素结构简式如图,下列有关叙述正确的是( )
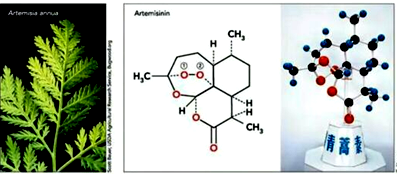

| A. | 青蒿素极易溶于水 | |
| B. | 1 mol青蒿素与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 青蒿素含有过氧键,有较强氧化性 | |
| D. | 青蒿素分子式为C15H21O5 |