题目内容
10.下列说法中正确的是( )| A. | P4和CH4分子的立体构型都是正四面体形且键角都为109°28' | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| C. | 单质的晶体中一定不存在阴离子 | |
| D. | SO2、BF3、NC13分子中所有原子的最外层电子均未达到8电子稳定结构 |
分析 A.白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心;
B.NaCl晶体中 与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置;
C.由阴离子和阳离子构成的物质属于离子化合物;
D.分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A.白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心,C-H键键角为白磷键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°,故A错误;
B.NaCl晶胞结构为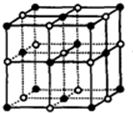 ,根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个,与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故B错误;
,根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个,与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故B错误;
C.由阴离子和阳离子构成的物质属于离子化合物,则含有阴离子的一定是离子化合物,所以在单质的晶体中一定不存在阴离子,故C正确;
D.NC13中N原子最外层电子数5+化合价的绝对值3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数7+化合价的绝对值1=8,所以C1原子达到8电子稳定结构,SO2 分子中S原子最外层电子数为6+4=10,不满足8电子结构,BF3中,B元素位于第ⅢA族,则3+3≠8,不满足分子中所有原子都满足最外层8电子结构,故D错误;
故选C.
点评 本题考查晶体结构、原子结构等知识,掌握8电子结构判断的方法,注意利用化合价(共价键数目)与最外层电子数来分析,注意氯化钠的结构高频考点,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
20.短周期元素A、B、C、D的原子序数依次增大.它们的原子序数之和为36,且原子的最外层电子数之和为14; A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D分别为同主族元素.下列叙述正确的是( )
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
1.有人分析一些小而可溶的有机分子的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是( )
| A. | 脂肪酸 | B. | 氨基酸 | C. | 葡萄糖 | D. | 核糖 |
18.除去混在蛋白质胶体中的NaCl,应选择的方法是( )
| A. | 过滤 | B. | 渗析 | C. | 蒸发结晶 | D. | 分液 |
15. T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
(1)TY2是一种常用的溶剂,是非极性分子(填极性分子或非极性分子),1mol TY2中存在2NA个σ键.
(2)写出X与NaOH溶液反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)Z的基态原子核外电子排布式为1s22s22p63s23p63d104s1,ZYO4溶液常作电镀液,其中YO42-的空间构型是正四面体.
(4)将WH3的水溶液逐滴滴加到ZYO4溶液中,现象为首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液,相应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;.
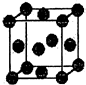
(5)已知Z的晶胞结构如图所示,该晶体的原子堆积模型为面心立方最密堆积,又知Z的密度为ρg/cm3,则晶胞边长为$\root{3}{\frac{256}{ρ{N}_{A}}}$ cm(用含p代数式表示).
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有三个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(2)写出X与NaOH溶液反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)Z的基态原子核外电子排布式为1s22s22p63s23p63d104s1,ZYO4溶液常作电镀液,其中YO42-的空间构型是正四面体.
(4)将WH3的水溶液逐滴滴加到ZYO4溶液中,现象为首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液,相应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;.
(5)已知Z的晶胞结构如图所示,该晶体的原子堆积模型为面心立方最密堆积,又知Z的密度为ρg/cm3,则晶胞边长为$\root{3}{\frac{256}{ρ{N}_{A}}}$ cm(用含p代数式表示).
2.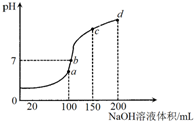 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
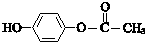
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.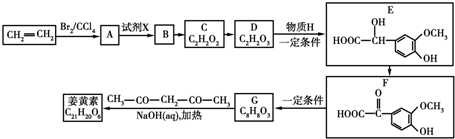


 .
.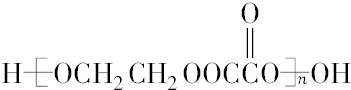 .
. .
.