题目内容
16.请用下列10种物质的序号填空:①O2;②H2;③NH4NO3;④K2O2;⑤Ba(OH)2;⑥CH4; ⑦CO2;⑧NaF;⑨NH3;⑩I2.其中由非极性键形成的分子是①②⑩;由极性键形成的分子是⑥⑦⑨;既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①O2中只含有非极性共价键,属于单质,属于非极性分子;
②H2 中只含非极性共价键,属于单质,属于非极性分子;
③NH4NO3含有极性共价键和离子键,属于离子化合物;
④K2O2 含有非极性共价键和离子键,属于离子化合物;
⑤Ba(OH)2含有极性共价键和离子键,属于离子化合物;
⑥CH4中只含极性共价键,属于共价化合物,属于非极性分子;
⑦CO2中只含极性共价键,属于共价化合物,属于非极性分子;
⑧NaF中只含离子键,属于离子化合物;
⑨NH3中只含极性共价键,属于共价化合物,属于极性分子,
⑩I2中只含有非极性共价键,属于单质,属于非极性分子;
(1)由非极性键形成的分子是①②⑩,故答案为:①②⑩;
(2)由极性键形成的分子是⑥⑦⑨,故答案为:⑥⑦⑨;
(3)既有离子键又有非极性键的是④;故答案为:④;
(4)既有离子键又有极性键的是③⑤;故答案为:③⑤.
点评 本题考查了物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.向溶液X中持续通入气体Y,不会产生“浑浊→澄清”现象的是( )
| A. | X:澄清石灰水,Y:二氧化硫 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
7.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝 | 金属铁比铜活泼 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
4.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
8.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热使氯化铵分解 | D. | 氯化氢气体溶于水 |
5.下列化学反应中,属于氧化还原反应的是( )
| A. | C+O2═CO2 | B. | NH3+HCl═NH4Cl | ||
| C. | 2Fe(OH)3═Fe2O3+3H2O | D. | NaOH+HNO3═NaNO3+H2O |
6.下列陈述 I、陈述 II均正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2能使溴水褪色 | SO2具有还原性 |
| B | NH3能使酚酞溶液变红 | NH3可用于设计喷泉 |
| C | SiO2能与氢氟酸、碱反应 | SiO2是两性氧化物 |
| D | 晶体Si熔点高硬度大 | 晶体Si可用作半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
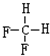 和
和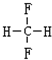
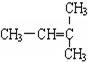 和CH2=CH-CH3
和CH2=CH-CH3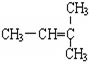 和
和