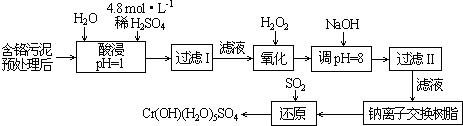
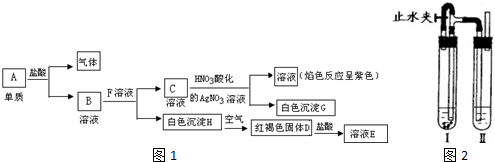
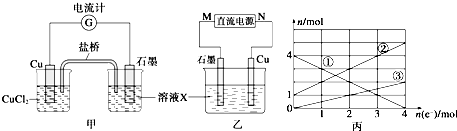
题目内容
已知某物质X能发生如图转化:X
Y
Z
A,下列有关上述转化关系中物质及其反应的叙述不正确的是( )
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| A、若X为N2或NH3,则A为硝酸 |
| B、若X为S或H2S,则A为硫酸 |
| C、若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D、反应①和一定为氧化还原反应,反应一定为非氧化还原反应 |
考点:无机物的推断
专题:
分析:由转化关系可知,X能发生连续氧化,则由氨气和氧气反应生成一氧化氮,最终实现转化的生成物是硝酸;S在氧气中反应生成二氧化硫,再被氧化后产物和水反应生成的是硫酸,A为硫酸或硝酸,X为氮气、氨气、S或H2S等,以此来解答.
解答:
解:A.若X为N2或NH3,Y为NO,Z为NO2,则A为硝酸,故A正确;
B.若X为S或H2S,Y为SO2,Z为SO3,则A为硫酸,故B正确;
C.若X为非金属单质或非金属氢化物,A为硝酸和硫酸,稀硝酸与Cu反应Y,浓硝酸和Cu反应不生成Y,且Cu与稀硫酸不反应,则A不一定能与金属铜反应生成Y,故C正确;
D.反应①和②一定为氧化还原反应,反应③若为二氧化氮和水的反应一定为氧化还原反应,故D错误;
故选:D.
B.若X为S或H2S,Y为SO2,Z为SO3,则A为硫酸,故B正确;
C.若X为非金属单质或非金属氢化物,A为硝酸和硫酸,稀硝酸与Cu反应Y,浓硝酸和Cu反应不生成Y,且Cu与稀硫酸不反应,则A不一定能与金属铜反应生成Y,故C正确;
D.反应①和②一定为氧化还原反应,反应③若为二氧化氮和水的反应一定为氧化还原反应,故D错误;
故选:D.
点评:本题考查无机物的推断,侧重氮及其化合物、硫及其化合物知识的考查,把握转化关系中X连续氧化为解答的突破口,属于综合知识的考查,综合性较强,注意利用验证法进行,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列不属于蛋白质变性的是( )
| A、鸡蛋白溶液中加入硫酸铵溶液变浑浊 |
| B、用福尔马林溶液浸泡动物标本 |
| C、用波尔多液(含CuSO4等)防治作物病虫害 |
| D、医院用加热法消毒医疗器械 |
下列说法不正确的是( )
| A、氧化镁用作耐火材料 |
| B、向Na2CO3溶液中滴加醋酸溶液,一定有CO2气体生成 |
| C、明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| D、Na2O2常用于潜水艇或呼吸面具的供氧剂 |
下列分子为直线形分子且分子中原子都满足8电子稳定结构( )
| A、BeCl2 |
| B、C2H2 |
| C、CO2 |
| D、SO2 |
不可能通过观察法了解的金属钠的性质是( )
| A、钠是一种银白色金属 |
| B、熔点为97.81℃,密度为0.97 g?cm-3 |
| C、钠与H2O剧烈反应 |
| D、钠在室温下氧化和在空气中燃烧得到不同的产物 |