题目内容
有关物质A~H的转化关系如图1
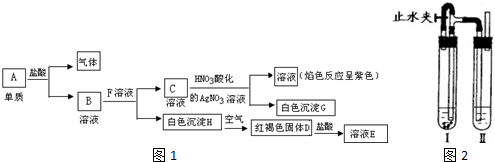
回答下列问题:
(1)写出下列物质的化学式E ;F ; C .
(2)A→B的离子方程式 .
(3)H→D的化学方程式 .
(4)在如图2示装置中,用NaOH溶液、铁屑、稀H2SO4可以制得纯净的白色H沉淀:在试管Ⅰ里加入的试剂是 和 ,在试管Ⅱ里加入的试剂是 .打开止水夹,塞紧塞子后,检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹.这样生成的H沉淀能较长时间保持白色,其理由是 .

回答下列问题:
(1)写出下列物质的化学式E
(2)A→B的离子方程式
(3)H→D的化学方程式
(4)在如图2示装置中,用NaOH溶液、铁屑、稀H2SO4可以制得纯净的白色H沉淀:在试管Ⅰ里加入的试剂是
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:C加入硝酸酸化的硝酸银,生成白色沉淀,焰色反应呈紫色,应为KCl,由白色沉淀H的变化可知H为Fe(OH)2,D为Fe(OH)3,E为FeCl3,可知A为Fe,B为FeCl2,F为KOH,结合对应物质的性质以及题目要求解答该题.
解答:
解:C加入硝酸酸化的硝酸银,生成白色沉淀,焰色反应呈紫色,应为KCl,由白色沉淀H的变化可知H为Fe(OH)2,D为Fe(OH)3,E为FeCl3,可知A为Fe,B为FeCl2,F为KOH,
(1)由以上分析可知,E为FeCl3,F为KOH,C为KCl,故答案为:FeCl3;KOH;KCl;
(2)A→B的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)H→D的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅰ里加入的试剂是铁屑与稀H2SO4,在试管Ⅱ里加入的试剂是氢氧化钠溶液,
打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后检验A口排出气体的纯度,氢气纯时,说明空气排尽,关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,这样生成的Fe(OH)2沉淀能较长时间保持白色,原因是试管Ⅰ中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化,
故答案为:铁屑;稀硫酸;氢氧化钠溶液;试管Ⅰ中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
(1)由以上分析可知,E为FeCl3,F为KOH,C为KCl,故答案为:FeCl3;KOH;KCl;
(2)A→B的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)H→D的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅰ里加入的试剂是铁屑与稀H2SO4,在试管Ⅱ里加入的试剂是氢氧化钠溶液,
打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后检验A口排出气体的纯度,氢气纯时,说明空气排尽,关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,这样生成的Fe(OH)2沉淀能较长时间保持白色,原因是试管Ⅰ中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化,
故答案为:铁屑;稀硫酸;氢氧化钠溶液;试管Ⅰ中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
点评:本题考查较为综合,涉及无机物的推断以及氢氧化亚铁的制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,难度不大,注意相关物质的性质.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列说法错误的是( )
| A、向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42- |
| B、向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42- |
| C、向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl- |
| D、向自来水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自来水中含有Cl- |
已知某物质X能发生如图转化:X
Y
Z
A,下列有关上述转化关系中物质及其反应的叙述不正确的是( )
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| A、若X为N2或NH3,则A为硝酸 |
| B、若X为S或H2S,则A为硫酸 |
| C、若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D、反应①和一定为氧化还原反应,反应一定为非氧化还原反应 |
下列说法不正确的是( )
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
下列关于Na2CO3和NaHCO3的性质的比较中,正确的是( )
| A、热稳定性:Na2CO3>NaHCO3 |
| B、常温时在水中的溶解度:NaHCO3>Na2CO3 |
| C、与稀盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D、等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 H2(g)+O2(g)═H2O(l)△H=-285.8kJ?mol-1由此可知,在等温下蒸发36g液态水需吸收的热量( )
| A、483.6 kJ |
| B、88 kJ |
| C、285.8 kJ |
| D、44 kJ |
 ;△H1
;△H1