题目内容
19.工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4•7H2O的工艺流程如下: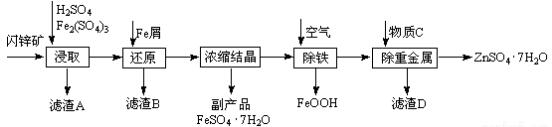
(1)“浸取”步骤中,为了提高反应速率,可以采取的措施是加热或搅拌或增大硫酸浓度等.
(2)加入铁屑时发生反应的化学方程式为Fe2(SO4)3+Fe=FeSO4、Fe+H2SO4═FeSO4+H2↑.
(3)通入空气“除铁”属于氧化还原反应.(填“氧化还原”或“非氧化还原”)
(4)该过程中在通入空气的入口处设计了一个类似淋浴喷头的装置,其目的是加快反应速率.
(5)置换法除重金属离子所用物质C为Zn.
分析 闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率;
(2)铁与硫酸铁、硫酸反应生成硫酸亚铁,据此写出反应的化学方程式;
(3)除铁是利用空气中氧气氧化亚铁离子生成FeOOH;
(4)依据增大物质接触面积会加快反应速率分析;
(5)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析.
解答 解:闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等;
故答案为:加热或搅拌或增大硫酸浓度等;
(2)加入铁粉后,剩余的硫酸铁、硫酸都能够与铁发生反应,反应的化学方程式为:Fe2(SO4)3+Fe=FeSO4、Fe+H2SO4═FeSO4+H2↑,
故答案为:Fe2(SO4)3+Fe=FeSO4、Fe+H2SO4═FeSO4+H2↑;
(3)除铁过程是利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+,该反应为氧化还原反应,
故答案为:氧化还原;
(4)在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,
故答案为:加快反应速率;
(5)制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn.
点评 本题考查了物质制备方案的设计,题目难度中等,根据制备流程明确制备原理为解答关键,注意掌握物质制备方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |

| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
| A. | 醋酸除水垢:2CH3COO-+2H++CaCO3═(CH3COO)2Ca+CO2↑+H2O | |
| B. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 稀硫酸除铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| D. | 酸性条件下KIO3与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- |