题目内容
14.以下是一些物质的熔沸点数据(常压):| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
完成下列填空:
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$.
(2)请写出一条既能提高反应速率又能提高转化率的方法:增大压强
(3)890℃,下列关于该反应的说法正确的是b(选填序号).
a.容器内气体的平均式量不再变化,则反应一定达到平衡
b.容器内固体质量不再变化,则反应一定达到平衡
c.反应起始至平衡,气体的密度不断增大
d.反应起始至平衡,容器内的压强不断增大
(4)890℃,若该反应在10L密闭容器、常压下进行,反应4h,固体质量增加56克,则二氧化碳的反应速率为0.35mol/(L•h)
(5)若温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将增大(选填“增大”“减小”“不变”),
(6)若反应后要得到纯净的金刚石,请写出必要的实验操作步骤.冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石
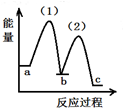
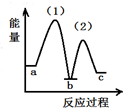
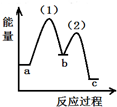
(7)在此反应中,同时还会有石墨生成,已知:C(s,石墨)?C(s,金刚石)-1.9KJ,若升高温度,生成的碳单质中,金刚石的含量将增大(选填“增大”“减小”“不变”).等物质的量的石墨和金刚石中,化学键的数目较多的是金刚石.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)升高温度、增大压强等可以加快反应速率,同时提高转化率,应是平衡正向移动;
(3)a.容器内气体只有钠蒸汽、二氧化碳,若起始时二者物质的量之比为4:3,且二者按4:3反应,气体的平均式量为定值;
b.容器内固体质量不再变化,说明金刚石的质量不变;
c.气体的质量减小,若容器容积不变,气体的密度不断减小;
d.气体的物质的量减小,若容器容积不变,容器内的压强不断减小;
(4)固体质量增加56克,则金刚石的质量为56g,根据方程式计算参加反二氧化碳物质的量,再根据v=$\frac{△c}{△t}$计算v(CO2);
(5)若温度由890℃升高到1860℃,碳酸钠分解生成二氧化碳,混合气体中二氧化碳的含量增大,容器内气体的平均相对分子质量增大;
(6)将产物冷却后,用水溶解,过滤除去碳酸钠,再洗涤干燥可得纯净的金刚石;
(7)石墨转化为金刚石为吸热反应,升高温度有利于石墨转化为金刚石;
石墨中每个C原子与周围碳原子形成3个C-C键,而金刚石中每个C原子与周围的4个C原子形成4个C-C键.
解答 解:(1)若反应在常压、890℃下进行,钠为气体,4Na+3CO2?2Na2CO3+C(s,金刚石)的平衡常数表达式K=$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$,
故答案为:$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$;
(2)正反应为气体体积减小的反应,增大压强可以加快反应速率,且平衡正向移动,同时提高转化率,
故答案为:增大压强;
(3)a.容器内气体只有钠蒸汽、二氧化碳,若起始时二者物质的量之比为4:3,且二者按4:3反应,气体的平均式量为定值,故a错误;
b.容器内固体质量不再变化,说明金刚石的质量不变,反应到达平衡,故b正确;
c.气体的质量减小,若容器容积不变,气体的密度不断减小,故c错误;
d.气体的物质的量减小,若容器容积不变,容器内的压强不断减小,故d错误,
故选:b;
(4)固体质量增加56克,则金刚石的质量为56g,其物质的量为$\frac{56g}{12g/mol}$=$\frac{14}{3}$mol,由方程式可知参加反二氧化碳物质的量为$\frac{14}{3}$mol×3=14mol,故v(CO2)=$\frac{\frac{14mol}{10L}}{4h}$=0.35 mol/(L•h),
故答案为:0.35;
(5)若温度由890℃升高到1860℃,碳酸钠分解生成二氧化碳,混合气体中二氧化碳的含量增大,容器内气体的平均相对分子质量增大,
故答案为:增大;
(6)冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石,
故答案为:冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石;
(7)石墨转化为金刚石为吸热反应,升高温度有利于石墨转化为金刚石,金刚石的含量将增大;
石墨中每个C原子与周围碳原子形成3个C-C键,而金刚石中每个C原子与周围的4个C原子形成4个C-C键,等物质的量的石墨和金刚石中,金刚石含有的化学键的数目较多,
故答案为:增大;金刚石.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、物质的提纯、晶体结构等,是对学生综合能力的考查,难度中等.

| A. | 生成一种新分子 | B. | 生成一种新离子 | ||
| C. | 生成一种新同位素 | D. | 生成一种新单质 |
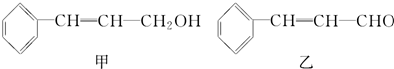
丙(见下表)
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
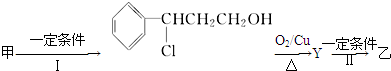
反应Ⅱ的化学方程式为
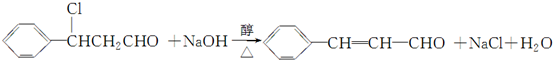 (注明反应条件).
(注明反应条件).(3)已知:RCH═CHR′$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R′CHO;
2CHO$→_{ii.H+}^{i.浓NaOH}$HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
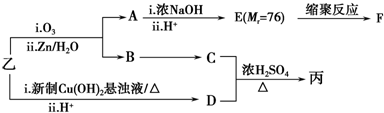
①下列物质不能与C反应的是c(选填序号).
a.金属钠 b.乙酸 c.Na2CO3溶液 d. HBr
②写出F的结构简式
 .
.③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式
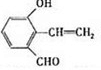 .
.a.苯环上连接三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为
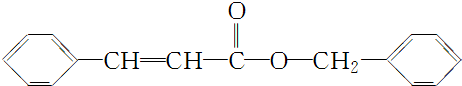 .
. 
 、
、 、
、 .
.