题目内容
以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后不会产生沉淀的是( )
| A、AlCl3,Ba(OH)2,HCl |
| B、BaCl2,Na2CO3,NaCl |
| C、MgCl2,NaOH,HNO3 |
| D、NaAlO2,NaOH,H2SO4 |
考点:离子反应发生的条件
专题:
分析:A.物质的量相等时,氯化氢能够消耗氢氧化钡溶液中一半的氢氧根离子,剩余的氢氧根离子与铝离子反应生成氢氧化铝沉淀;
B.氯化钡与碳酸钠溶液反应生成碳酸钡沉淀;
C.氢氧化钠与硝酸恰好发生中和反应生成硝酸钠和水,不会生成氢氧化镁沉淀;
D.氢氧化钠能够中和硫酸中一半的氢离子,剩余氢离子与偏铝酸钠反应生成氢氧化铝沉淀.
B.氯化钡与碳酸钠溶液反应生成碳酸钡沉淀;
C.氢氧化钠与硝酸恰好发生中和反应生成硝酸钠和水,不会生成氢氧化镁沉淀;
D.氢氧化钠能够中和硫酸中一半的氢离子,剩余氢离子与偏铝酸钠反应生成氢氧化铝沉淀.
解答:
解:A.AlCl3、Ba(OH)2、HCl,三者物质的量相等时,氢氧根离子过量,则镁离子与氢氧根离子反应生成氢氧化铝沉淀,故A错误;
B.BaCl2、Na2CO3发生反应生成碳酸钡沉淀,故B错误;
C.等物质的量的NaOH、HNO3恰好发生中和反应,不会生成氢氧化镁沉淀,故C正确;
D.等物质的量的NaOH,H2SO4反应后氢离子有剩余,剩余氢离子与NaAlO2反应生成氢氧化铝沉淀,故D错误;
故选C.
B.BaCl2、Na2CO3发生反应生成碳酸钡沉淀,故B错误;
C.等物质的量的NaOH、HNO3恰好发生中和反应,不会生成氢氧化镁沉淀,故C正确;
D.等物质的量的NaOH,H2SO4反应后氢离子有剩余,剩余氢离子与NaAlO2反应生成氢氧化铝沉淀,故D错误;
故选C.
点评:本题考查了离子反应发生条件,题目难度不大,试题侧重基础知识的考查,明确离子反应发生条件是解答关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为1.00g/L,则混合气体中N2和CH4的体积之比为( )
| A、8:7 | B、1:4 |
| C、4:1 | D、1:1 |
下列化学用语中,不正确的是( )
A、氯原子结构示意图: |
B、HCl的电子式: |
| C、乙烯的结构简式:CH2=CH2 |
D、乙炔的比例模型: |
用已知浓度盐酸滴定未知浓度的NaOH溶液时,下列操作使测定结果(NaOH溶液的浓度)偏高的是( )
| A、滴定达终点时,俯视读数 |
| B、碱液移入锥形瓶后,加入10mL蒸馏水 |
| C、酸式滴定管用蒸馏水洗涤后,未用标准液润洗 |
| D、滴定振荡锥形瓶过程中,有少量溶液溅出 |
下列图中,做法正确的是( )
A、 闻气体气味 |
B、 点燃酒精灯 |
C、 过滤 |
D、 移开蒸发皿 |
能用分液漏斗分离的混合物是( )
| A、液溴和四氯化碳 |
| B、乙醇和乙酸 |
| C、生石灰和乙醇溶液 |
| D、苯和蒸馏水 |
以下实验操作或方法不正确的是( )
A、 闻气体的气味 |
B、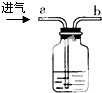 用浓硫酸 |
C、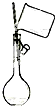 向容量瓶中转移液体 |
D、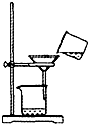 过滤 |