题目内容
9.计算:常温下,在32g水中溶解8g CuSO4,恰好达到饱和,该溶液密度为1.21g/cm3,求:①该溶液中Cu2+和SO42-的总物质的量
②该溶液中CuSO4的物质的量浓度
③取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
分析 ①根据n=$\frac{m}{M}$计算出硫酸铜的物质的量,然后可计算出该溶液中Cu2+和SO42-的总物质的量;
②根据溶液的质量和密度计算溶液的体积,物质的量除以体积可得物质的量浓度;
②根据溶液稀释前后溶质的物质的量不变计算体积.
解答 解:①8gCuSO4的物质的量为:$\frac{8g}{160g/mol}$=0.050mol,0.05mol硫酸铜中含有Cu2+和SO42-的总物质的量为:0.050mol+0.050mol=0.10mol,
答:该溶液中Cu2+和SO42-的总物质的量为0.10mol;
②溶液的体积为:$\frac{32g+8g}{1210g/L}$=0.033L,
该溶液中CuSO4的物质的量浓度为:$\frac{0.050mol}{0.033L}$=1.51 mol/L,
答:该溶液中CuSO4的物质的量浓度为1.51 mol/L;
(3)取出溶液中含溶质硫酸铜的物质的量为:1.51 mol/•L×0.02L=0.0302mol,
则稀释后溶液的体积为:$\frac{0.0302mol}{1.00mol/L}$=0.0302L=30.2 mL,
答:稀释后溶液的体积是30mL.
点评 本题主要考查物质的量浓度的有关计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,注意溶液稀释前后溶质的物质的量不变,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
7.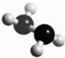 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
20.下列物质能使KMnO4酸性溶液褪色,不能使溴水褪色的是( )
| A. | 苯 | B. | 丙烯 | C. | 二甲苯 | D. | 己烷 |
4.下列有关实验的说法正确的是( )
| A. | 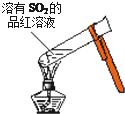 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 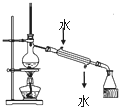 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
14.下列7种物质中,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色的是( )
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
1.提出元素周期律并根据周期律编制第一个元素周期表的科学家是( )
| A. | 道尔顿 | B. | 拉瓦锡 | C. | 门捷列夫 | D. | 阿伏加德罗 |
18.在一定温度下将amol PCl5充入一密闭容器中达到如下平衡:PCl5(g)?PCl3(g)+Cl2(g),此时压强为P1;再向容器中通入amol PCl5,在同温下又达到平衡时的压强为P2,则下列说法中正确的是( )
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
19.在1~18号元素中,最外层电子数等于电子层数的元素有( )
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 4种 |
 ;
; ;
;