题目内容
NA表示阿伏加德罗常数,下列说法错误的是( )
| A、56g铁与足量的氯气反应,转移电子数为3NA |
| B、常温常压下,22.4L甲烷所含的电子数为10NA |
| C、常温常压下,34g氨气所含的原子数为8NA |
| D、NA个氧分子和NA个氢分子的质量比为16:1 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、铁与氯气反应后变为+3价;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出氨气的物质的量n=
,根据氨气是四原子分子来计算;
D、NA个氢分子与NA个氧分子的物质的量都是1mol,氢气的摩尔质量为2g/mol,氧气的摩尔质量为32g/mol.
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出氨气的物质的量n=
| m |
| M |
D、NA个氢分子与NA个氧分子的物质的量都是1mol,氢气的摩尔质量为2g/mol,氧气的摩尔质量为32g/mol.
解答:
解:A、氯气的氧化性很强,铁与氯气反应后变为+3价,故56g铁即1mol铁反应时转移3mol电子,个数为3NA,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L甲烷的物质的量小于1mol,含有的电子数小于10NA个,故B错误;
C、氨气的物质的量n=
=
=2mol,而氨气是四原子分子,故2mol氨气中含8mol原子,故C正确;
D、NA个氧分子与NA个氢分子的数目相等,则其质量之比等于其相对分子量之比,所以二者的质量之比为:32:2=16:1,故D正确;
故选B.
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L甲烷的物质的量小于1mol,含有的电子数小于10NA个,故B错误;
C、氨气的物质的量n=
| m |
| M |
| 34g |
| 17g/mol |
D、NA个氧分子与NA个氢分子的数目相等,则其质量之比等于其相对分子量之比,所以二者的质量之比为:32:2=16:1,故D正确;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
钢铁在潮湿的空气中会被腐蚀,会发生的原电池反应.以下说法正确的是( )
| A、负极发生的反应为:Fe-3e-=Fe3+ |
| B、正极发生的反应为:2H2O+O2+4e-=4OH? |
| C、原电池是将电能转变为化学能的装置 |
| D、钢铁在水下部分比在空气与水交界处更容易腐蚀 |
照反应Br+H2?HBr+H的能量变化示意图,下列叙述正确的是( )
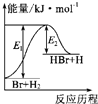

| A、该反应的△H=+(E1-E2)kJ?mol-1 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应为放热反应 |
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、15g甲基(-CH3)所含有的电子数是10NA | ||
| B、0.5mol 1,3一丁二烯分子中含有的碳碳双键数为NA | ||
C、标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为
| ||
| D、60gSiO2晶体中,含有NA个Si-O键 |
高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
| A、制高铁酸钾用 KClO做还原剂 |
| B、Fe(OH)3是还原剂 |
| C、高铁酸钾中铁的化合价为+7 |
| D、制备高铁酸钾时1 molFe(OH)3得到3 mol电子 |
下列各表达式中,属于水解反应的是( )
| A、HCO3-+H2O?H3O++CO32- |
| B、NH4++OH-?NH3?H2O |
| C、HSO3-+H2O?H2SO3+OH- |
| D、H2O+H2O?H3O++OH- |
 LED晶片在文化传媒中有着广泛的应用.目前市售LED晶片,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.
LED晶片在文化传媒中有着广泛的应用.目前市售LED晶片,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.