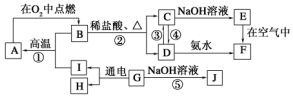
题目内容
3.下列有关物质的分离提纯的方法和操作正确的是( )| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |
分析 A.分液时,密度大的液体从下口分离;
B.过滤时不能搅拌,易捣破滤纸;
C.酒精与水互溶;
D.海水中水的沸点低.
解答 解:A.用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从下口放出,故A错误;
B.过滤时不能搅拌,易捣破滤纸,应使水自然流下,故B错误;
C.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳萃取碘水中的碘,故C错误;
D.海水中水的沸点低,则海水通过蒸馏可制得淡水,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
13.0.1mol/L NH4Cl溶液中,下列叙述错误的是( )
| A. | c(NH4+)>c(Cl-)>c(OH- )>c( H+ ) | B. | c(Cl-)>c(NH4+)>c( H+ )>c(OH-) | ||
| C. | c(NH4+)+c( H+ )=c(Cl-)+c(OH- ) | D. | c(NH4+)+c( NH3•H2O )=c(Cl-) |
8. 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
13.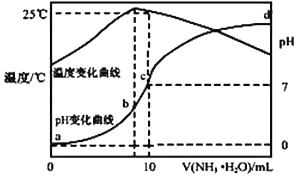 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
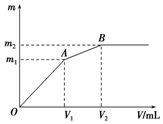 向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上. ;
; ;
; .
.