题目内容
5.实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空.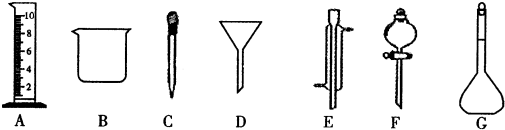
(1)写出仪器名称:E冷凝管,F分液漏斗.
(2)下列实验操作中用到仪器D的是C(选填下列选项的编号字母 ).
A.分离水和CC14的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物.
分析 (1)由图可知仪器名称;
(2)D为漏斗,用于分离不溶性固体与液体.
解答 解:(1)E、F分别为冷凝管、分液漏斗,故答案为:冷凝管;分液漏斗;
(2)A.分离水和CC14的混合物,利用分液法,选择F,故A不选;
B.分离水和酒精的混合物,利用蒸馏法,选择E,故B不选;
C.分离水和泥砂的混合物,利用过滤法,选择D,故C选;
故答案为:C.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,注意仪器与分离方法,题目难度不大.

练习册系列答案
相关题目
15.ClO2是一种安全、高效、强力杀菌剂,其性质如表:
回答下列问题:
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
16.下列说法不正确的是( )
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
13.甲基环丙烷的二氯代物的数目有(不考虑立体异构)( )
| A. | 4 种 | B. | 5 种 | C. | 6 种 | D. | 7种 |
10.下列说法不正确的是( )
| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
17.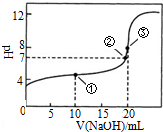 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
14.下列指定反应的离子方程式正确的是( )
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
15.下列实验方案或实验操作中,不能达到实验目的是( )
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
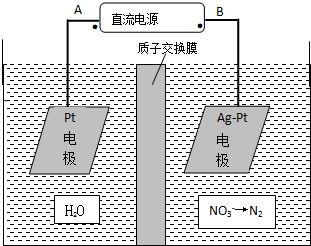 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答: