题目内容
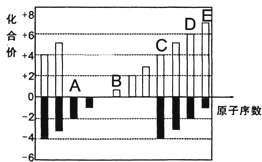 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.(1)A、B、C、D四种元素中第一电离能最小的是
(2)D、E的最高价氧化物的水化物中,酸性较强的是
(3)化合物CA2的晶体类型是
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,该反应的热化学方程式是
考点:位置结构性质的相互关系应用
专题:有机物的化学性质及推断
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A为-2价,则A为O元素;B为+1价,则B为Na元素;C为+4价,则C为Si元素;D为+7价,则D为S元素;E为+7价,则E为Cl元素,据此解答.
解答:
解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A为-2价,则A为O元素;B为+1价,则B为Na元素;C为+4价,则C为Si元素;D为+7价,则D为S元素;E为+7价,则E为Cl元素.
(1)由上述分析可知:Na元素的金属性最强,其第一电离能最小;Na的基态原子核外电子排布式为 1s22s22p63s1;
故答案为:钠;1s22s22p63s1;
(2)非金属性:Cl>S,故高价氧化物的水化物中,酸性较强的是HClO4;O的电负性较强,能形成氢键,故H2O的沸点高于H2S,
故答案为:HClO4;低;
(3)SiO2是原子晶体,SiO2是与NaOH反应生成硅酸钠和水,反应为SiO2+2OH-=SiO32-+H2O,
故答案为:原子晶体;SiO2+2OH-=SiO32-+H2O;
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,则△H=-
=-297.0 kJ?mol-1;
故答案为:S(s)+O2(g)=SO2(g)△H=-297.0 kJ?mol-1.
(1)由上述分析可知:Na元素的金属性最强,其第一电离能最小;Na的基态原子核外电子排布式为 1s22s22p63s1;
故答案为:钠;1s22s22p63s1;
(2)非金属性:Cl>S,故高价氧化物的水化物中,酸性较强的是HClO4;O的电负性较强,能形成氢键,故H2O的沸点高于H2S,
故答案为:HClO4;低;
(3)SiO2是原子晶体,SiO2是与NaOH反应生成硅酸钠和水,反应为SiO2+2OH-=SiO32-+H2O,
故答案为:原子晶体;SiO2+2OH-=SiO32-+H2O;
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,则△H=-
| 14.85kJ |
| 1.6g/32g?mol-1 |
故答案为:S(s)+O2(g)=SO2(g)△H=-297.0 kJ?mol-1.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意基础知识的理解掌握.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
 常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )| A、图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- |
| B、当V[NaOH(aq)]=20mL时,溶液中由水电离出的c(OH-)大于10-7 mol?L-1 |
| C、当V[NaOH(aq)]=40 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |


 )也是医药工业的重要原料,下列有机物属 于水杨酸同系物的是
)也是医药工业的重要原料,下列有机物属 于水杨酸同系物的是
 如图(图中有部分仪器未画出),有一容积为300ml的注射器,与一500ml的蒸馏烧瓶相连,烧瓶中有0.384g铜片.现向烧瓶中加入18mL2.5mol.L-1的HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口.试回答:
如图(图中有部分仪器未画出),有一容积为300ml的注射器,与一500ml的蒸馏烧瓶相连,烧瓶中有0.384g铜片.现向烧瓶中加入18mL2.5mol.L-1的HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口.试回答: 已知:一个碳原子上连两个羟基时自动脱水形成醛基,即:
已知:一个碳原子上连两个羟基时自动脱水形成醛基,即: 现有A~F六种有机物,存在如图所示的转化关系.据此完成下列问题:
现有A~F六种有机物,存在如图所示的转化关系.据此完成下列问题: