题目内容
 如图(图中有部分仪器未画出),有一容积为300ml的注射器,与一500ml的蒸馏烧瓶相连,烧瓶中有0.384g铜片.现向烧瓶中加入18mL2.5mol.L-1的HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口.试回答:
如图(图中有部分仪器未画出),有一容积为300ml的注射器,与一500ml的蒸馏烧瓶相连,烧瓶中有0.384g铜片.现向烧瓶中加入18mL2.5mol.L-1的HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口.试回答:(1)欲提高Cu和稀HNO3的反应速率,可采取几种不同的措施:
a.若采用加入化学试剂的方法,可加入
A.水 B.无水醋酸钠 C.铜粉
b.若采用高度升温的方法,还需用的仪器有
(2)橡皮塞用锡箔包住的原因是
(3)反应开始后,烧瓶中可观察到的现象主要有:①
(4)停止反应后,轻轻推拉注射器活塞,使气体与气体,气体与液体皆充分反应.若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时相比
A.不变 B.变大 C.变小.
考点:性质实验方案的设计
专题:实验题
分析:(1)增大反应速率,则升高温度或增大固体表面积;
(2)硝酸可腐蚀橡胶塞;
(3)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,一氧化氮和氧气反应;
(4)空气总体积为800mL,氧气体积为800mL×20%=160mL,物质的量约为
=0.0071mol,n(Cu)=
=0.006mol,结合电子的转移判断..
(2)硝酸可腐蚀橡胶塞;
(3)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,一氧化氮和氧气反应;
(4)空气总体积为800mL,氧气体积为800mL×20%=160mL,物质的量约为
| 0.16L |
| 22.4L/mol |
| 0.384g |
| 64g/mol |
解答:
解:(1)a.欲提高Cu和稀HNO3的反应速率,可增大固体表面积或增大浓度,只有C符合,故答案为:C;
b.若采用高度升温的方法,可用酒精灯加热,故答案为:酒精灯;
(2)硝酸可腐蚀橡胶塞,应用锡箔包住,故答案为:防止橡胶塞被硝酸腐蚀(氧化);
(3)铜和稀硝酸反应生成硝酸铜,溶液变蓝,生成一氧化氮和水,可观察到有气泡生成,一氧化氮和氧气反应,气体逐渐变成红棕色,
故答案为:①铜片逐渐溶解,铜片表面有气体逸出;②溶液颜色变蓝;③气体逐渐变成红棕色;
(4)n(Cu)=
=0.006mol,n(HNO3)=2.5mol/L×0.018L=0.045mol,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,由方程式可知硝酸过量,铜完全反应,
铜失去电子的物质的量为0.006mol×2=0.012mol,可生成n(NO)=
×0.006mol=0.004mol,与氧气发生4NO+3O2+2H2O=4HNO3,
则需要(O2)=0.004mol×
=0.003mol,V(O2)=0.003mol×22.4L/mol=0.0672L=672mL,
而空气总体积为800mL,氧气体积为800mL×20%=160mL,则停止反应后,轻轻推拉注射器活塞,使气体与气体,气体与液体皆充分反应,氧气不足,有NO剩余,
所以最终溶液中NO3-的物质的量浓度与开始时相比变小,
故答案为:C.
b.若采用高度升温的方法,可用酒精灯加热,故答案为:酒精灯;
(2)硝酸可腐蚀橡胶塞,应用锡箔包住,故答案为:防止橡胶塞被硝酸腐蚀(氧化);
(3)铜和稀硝酸反应生成硝酸铜,溶液变蓝,生成一氧化氮和水,可观察到有气泡生成,一氧化氮和氧气反应,气体逐渐变成红棕色,
故答案为:①铜片逐渐溶解,铜片表面有气体逸出;②溶液颜色变蓝;③气体逐渐变成红棕色;
(4)n(Cu)=
| 0.384g |
| 64g/mol |
铜失去电子的物质的量为0.006mol×2=0.012mol,可生成n(NO)=
| 2 |
| 3 |
则需要(O2)=0.004mol×
| 3 |
| 4 |
而空气总体积为800mL,氧气体积为800mL×20%=160mL,则停止反应后,轻轻推拉注射器活塞,使气体与气体,气体与液体皆充分反应,氧气不足,有NO剩余,
所以最终溶液中NO3-的物质的量浓度与开始时相比变小,
故答案为:C.
点评:本题考查物质的性质探究,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,易错点为(3),注意结合反应的方程式计算.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
以NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A、58.5g氯化钠固体中含有NA个氯化钠分子 |
| B、5.6 g铁粉与酸反应失去的电子数一定为0.2NA |
| C、6.0g金刚石中含有的共价键数为NA |
| D、标况下,11.2LSO3所含的分子数为0.5NA |
下列说法正确的是( )
| A、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
有关实验室制乙烯的说法中,不正确的是( )
| A、温度计的水银球要伸入到反应物的液面以下 |
| B、反应过程中溶液的颜色逐渐变黑 |
| C、生成的乙烯气体中混有少量有刺激性气味的气体 |
| D、加热时不要太急,使温度缓慢上升至170℃ |
下列物质的工业制备原理不正确的是( )
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
 已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.
已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.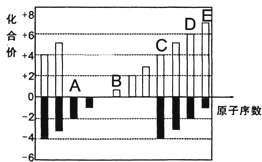 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.