题目内容
 常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )| A、图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- |
| B、当V[NaOH(aq)]=20mL时,溶液中由水电离出的c(OH-)大于10-7 mol?L-1 |
| C、当V[NaOH(aq)]=40 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、依据图象分析各自代表的物质即可;
B、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
C、当V(NaOH)=40mL时为Na2A溶液,根据A2-的水解程度进行判断;
D、二者恰好反应生成NaHA,加水稀释HA-电离和水解.
B、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
C、当V(NaOH)=40mL时为Na2A溶液,根据A2-的水解程度进行判断;
D、二者恰好反应生成NaHA,加水稀释HA-电离和水解.
解答:
解:A、据题意知图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,故A正确;
B、根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,故c(H+)>10-7 mol?L-1,故OH-<-7 mol?L-1,故B错误;
C、当V(NaOH)=40mL时,反应后的溶质为Na2A,A2-+H2O?HA-+OH-,由于水解程度很小,故c(A2-)>c(HA-)故C错误;
D.当加入V(NaOH)=20mL时,此时溶质为NaHA,根据图象可知,溶液中c(A2-)>c(H2A),说明HA-的电离程度大于其水解程度,溶液显示酸性,故D错误,故答案选择A.
B、根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,故c(H+)>10-7 mol?L-1,故OH-<-7 mol?L-1,故B错误;
C、当V(NaOH)=40mL时,反应后的溶质为Na2A,A2-+H2O?HA-+OH-,由于水解程度很小,故c(A2-)>c(HA-)故C错误;
D.当加入V(NaOH)=20mL时,此时溶质为NaHA,根据图象可知,溶液中c(A2-)>c(H2A),说明HA-的电离程度大于其水解程度,溶液显示酸性,故D错误,故答案选择A.
点评:本题考查酸碱混合溶液定性判断,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
下列物质的工业制备原理不正确的是( )
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
 已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.
已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.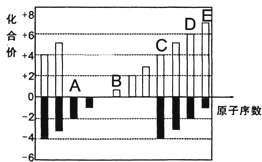 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.