题目内容
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如图1所示.

(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号).
A.醋酸 B.盐酸 C.硝酸 D.稀硫酸
(2)不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 .
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1:2,Sn2+转化为 (填离子符号).
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 .调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁.pH=4时,溶液中上述4种微粒含量最多的是 .

(1)酸洗时,为使水垢尽可能溶解,不宜选用的是
A.醋酸 B.盐酸 C.硝酸 D.稀硫酸
(2)不溶物用碳酸钠溶液浸泡时,反应的离子方程式是
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是
考点:难溶电解质的溶解平衡及沉淀转化的本质,pH的简单计算,铁盐和亚铁盐的相互转变
专题:基本概念与基本理论
分析:(1)稀硫酸会生成微溶物硫酸钙,会沉在反应物的表面,据此解答;
(2)沉淀物有向更难溶物转化的趋势,据此解答;
(3)依据反应原理写出离子反应方程式,依据氧化还原反应判断产物;
(4)依据平衡移动原理判断即可;依据题给信息判断含量最多的离子.
(2)沉淀物有向更难溶物转化的趋势,据此解答;
(3)依据反应原理写出离子反应方程式,依据氧化还原反应判断产物;
(4)依据平衡移动原理判断即可;依据题给信息判断含量最多的离子.
解答:
解:(1)若使用稀硫酸会生成微溶物硫酸钙,会沉在反应物的表面,使反应物不能完全反应故不能选硫酸,故答案为:D;
(2)在水垢进行酸化之后,只有硫酸钙是不溶物,加入碳酸钠,可生成溶解度更小的碳酸钙,故答案为:CaSO4+CO32-?CaCO3+SO42-;
(3)Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀铁质管道.据得失电子总数相等的原则,两摩尔的三价铁离子,变成亚铁离子,总共得到两摩尔的电子,所以一摩尔Sn2+转化为Sn4+,故答案为:Fe+2Fe3+=3Fe2+;Sn4+;
(4)H3R?H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少.H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d所以从图形上看,B点式最高的所以含量最多的是H2R-,故答案为:随溶液PH增大,平衡H3R?H2R-+H+向右移动所以,H3R的百分含量减小;H2R-.
(2)在水垢进行酸化之后,只有硫酸钙是不溶物,加入碳酸钠,可生成溶解度更小的碳酸钙,故答案为:CaSO4+CO32-?CaCO3+SO42-;
(3)Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀铁质管道.据得失电子总数相等的原则,两摩尔的三价铁离子,变成亚铁离子,总共得到两摩尔的电子,所以一摩尔Sn2+转化为Sn4+,故答案为:Fe+2Fe3+=3Fe2+;Sn4+;
(4)H3R?H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少.H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d所以从图形上看,B点式最高的所以含量最多的是H2R-,故答案为:随溶液PH增大,平衡H3R?H2R-+H+向右移动所以,H3R的百分含量减小;H2R-.
点评:本题主要考查的是离子反应方程式的书写、氧化还原反应原理的利用,属于常考题.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
有关实验室制乙烯的说法中,不正确的是( )
| A、温度计的水银球要伸入到反应物的液面以下 |
| B、反应过程中溶液的颜色逐渐变黑 |
| C、生成的乙烯气体中混有少量有刺激性气味的气体 |
| D、加热时不要太急,使温度缓慢上升至170℃ |
下列物质的工业制备原理不正确的是( )
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
一定温度下,Mg(OH)2在下列液体中的溶解度,由大到小的顺序是( )
①50mL蒸馏水;②20mL 0.5mol/L MgCl2溶液;③100mL 0.5mol/L NaOH溶液;④30mL 0.2mol/L NaHSO4溶液;⑤60mL 0.2mol/L NH4Cl溶液.
①50mL蒸馏水;②20mL 0.5mol/L MgCl2溶液;③100mL 0.5mol/L NaOH溶液;④30mL 0.2mol/L NaHSO4溶液;⑤60mL 0.2mol/L NH4Cl溶液.
| A、①②③④⑤ |
| B、④⑤①②③ |
| C、⑤④①②③ |
| D、④⑤①③② |
以下实验方案合理的是( )
| A、为了提高甲烷与氯气的反应速率,用阳光直射反应容器 |
| B、为了验证甲烷与氯气的反应产物之一为氯化氢,水槽中改用AgNO3溶液 |
| C、用溴水鉴别乙烷和乙烯 |
| D、用高锰酸钾溶液除去乙烷中的乙烯 |


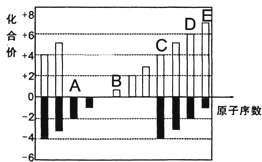 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示. 用Na2CO3?10H2O晶体,配制0.2mol?L-1的Na2CO3溶液480mL.
用Na2CO3?10H2O晶体,配制0.2mol?L-1的Na2CO3溶液480mL.