题目内容
在20mL 0.0025mol?L-1AgNO3溶液中,加入5mL 0.01mol?L-1KCl溶液,通过计算判断是否有AgCl沉淀生成.已知Ksp(AgCl)=1.8×10-10 (混合后溶液的总体积为两者体积之和).
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:氯化银的溶解平衡为:AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),求算出氯离子、银离子的物质的量,混合后体积为0.025L,再计算出c(Ag+)、c(Cl-),代入氯化银的溶度积判断即可.
解答:
解:由AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),混合后溶液体积是25mL,n(Cl-)=0.005L×0.01mol?L-1=0.0005mol,n(Ag+)=0.02L×0.0025mol?L-1=0.0005mol=1×10-4mol?L-1,c(Ag+)=
=0.0020mol?L-1,c(Cl-)=
=0.0020mol?L-1,则Ksp=c(Ag+)c(Cl-)=0.0020mol?L-1×0.0020mol?L-1=4×10-6mol2?L-2>1.8×10-10mol2?L-2,故有AgCl沉淀析出,
答:有AgCl沉淀析出,满足Q>Ksp.
| 20mL×0.0025mol/L |
| 25mL |
| 5mL×0.01mol/L |
| 25mL |
答:有AgCl沉淀析出,满足Q>Ksp.
点评:本题考查了根据难溶电解质溶度积判断沉淀情况,要形成沉淀,必须满足Q>Ksp;若两溶液等体积混合,离子浓度为混合前的一半.注意混合后溶液的体积的变化,题目难度一般.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列说法正确的是( )
| A、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
下列物质的工业制备原理不正确的是( )
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
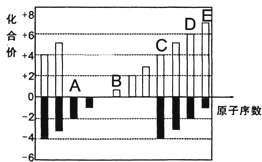 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示. 用Na2CO3?10H2O晶体,配制0.2mol?L-1的Na2CO3溶液480mL.
用Na2CO3?10H2O晶体,配制0.2mol?L-1的Na2CO3溶液480mL. 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )